BPT
-
ДЕКАПЕПТИЛ
ДЕКАПЕПТИЛ
(трипторелина ацетат)
(трипторелина ацетат)
ВРТ - НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
- КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
- ЛЕКАРСТВЕННАЯ ФОРМА
- КЛИНИЧЕСКИЕ ДАННЫЕ
- гиперчувствительность к трипторелину или к любому из вспомогательных веществ, перечисленных в разделе 6.1;
- гиперчувствительность к гонадотропин-рилизинг гормону (ГнРГ) или его аналогам;
- детский возраст до 18 лет;
- беременность и период грудного вскармливания.
- ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
- ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
- ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
- ДАТА ПЕРЕСМОТРА ТЕКСТА
-
МЕНОПУР®
МЕНОПУР®
(менотропины)
(менотропины)
ВРТ - НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
- КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
- ЛЕКАРСТВЕННАЯ ФОРМА
- КЛИНИЧЕСКИЕ ДАННЫЕ
- ановуляция (включая синдром поликистозных яичников (СПКЯ) при неэффективности терапии кломифеном);
- контролируемая гиперстимуляция яичников с целью индукции роста множественных фолликулов при проведении следующих вспомогательных репродуктивных технологий (ВРТ): экстракорпоральное оплодотворение с переносом эмбриона (ЭКО/ПЭ), перенос гамет в маточную трубу (ГИФТ) и интрацитоплазматическая инъекция спермы (ИКСИ).
- стимуляция сперматогенеза при азооспермии или олигоастеноспермии, обусловленными первичным или вторичным гипогонадотропным гипогонадизмом (в сочетании с препаратами чХГ).
- гиперчувствительность к менотропинам или к любому из вспомогательных веществ препарата и компонентам растворителя, перечисленных в разделе 6.1;
- опухоли гипофиза и гипоталамуса;
- возраст до 18 лет;
- нарушение функции печени или почек.
- рак яичников, матки или молочной железы;
- беременность и период грудного вскармливания;
- вагинальное кровотечение неясной этиологии;
- наличие кист или увеличение размера яичников, не связанных с СПКЯ;
- первичная недостаточность функции яичников;
- аномалии развития половых органов, несовместимые с беременностью;
- миома матки, несовместимая с беременностью.
- рак предстательной железы;
- опухоль яичек.
- ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
- ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
- ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
- ДАТА ПЕРЕСМОТРА ТЕКСТА
-
МЕНОПУР® Мультидоза
МЕНОПУР® Мультидоза
(менотропины)
(менотропины)
ВРТ - НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
- КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
- ЛЕКАРСТВЕННАЯ ФОРМА
- КЛИНИЧЕСКИЕ ДАННЫЕ
- ановуляция (включая синдром поликистозных яичников (СПКЯ) при неэффективности терапии кломифеном);
- контролируемая гиперстимуляция яичников с целью индукции роста множественных фолликулов при проведении следующих вспомогательных репродуктивных технологий (ВРТ): экстракорпоральное оплодотворение с переносом эмбриона (ЭКО/ПЭ), перенос гамет в маточную трубу (ГИФТ) и интрацитоплазматическая инъекция спермы (ИКСИ).
- стимуляция сперматогенеза при азооспермии или олигоастеноспермии, обусловленными первичным или вторичным гипогонадотропным гипогонадизмом (в сочетании с препаратами хорионического гонадотропина человека (чХГ).
- гиперчувствительность к менотропинам или к любому из вспомогательных веществ препарата и компонентам растворителя, перечисленных в разделе 6.1;
- опухоли гипофиза и гипоталамуса;
- возраст до 18 лет;
- нарушение функции печени или почек.
- рак яичников, матки или молочной железы;
- беременность и период грудного вскармливания;
- вагинальное кровотечение неясной этиологии;
- наличие кист или увеличение размера яичников, не связанных с СПКЯ;
- первичная недостаточность функции яичников;
- аномалии развития половых органов, несовместимые с беременностью;
- миома матки, несовместимая с беременностью.
- рак предстательной железы;
- опухоль яичек.
- ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
- ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
- Медленно введите растворитель во флакон (Рис. 3).
- Круговыми движениями аккуратно перемешайте содержимое флакона до получения прозрачного раствора (Рис. 4). Растворение обычно происходит за
1–2 минуты. Не встряхивать! Не используйте раствор в случае появления нерастворенных частиц или изменения цвета! - Наберите необходимое количество раствора в шприц для инъекции (Рис. 5, 6).
- Протрите место инъекции спиртовой салфеткой, удалите пузырьки воздуха из шприца и введите препарат, как показано на рис. 7.
- ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
- ДАТА ПЕРЕСМОТРА ТЕКСТА
-
РЕКОВЕЛЛЬ®
РЕКОВЕЛЛЬ®
(фоллитропин дельта)
(фоллитропин дельта)
ВРТ - НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
- КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
- ЛЕКАРСТВЕННАЯ ФОРМА
- КЛИНИЧЕСКИЕ ДАННЫЕ
- гиперчувствительность к фоллитропину дельта и/или к любому из вспомогательных веществ, перечисленных в разделе 6.1.;
- опухоли гипофиза или гипоталамуса;
- возраст до 18 лет;
- рак яичников, матки или молочной железы;
- кровотечение из половых путей неясной этиологии;
- наличие кист или увеличение размера яичников, не связанных с синдромом поликистозных яичников;
- первичная недостаточность функции яичников;
- аномалии развития половых органов, несовместимые с беременностью;
- миома матки, несовместимая с беременностью.
-
ХОРАГОН®
ХОРАГОН®
(гонадотропин хорионический)
(гонадотропин хорионический)
ВРТ
ДЕКАПЕПТИЛ (трипторелина ацетат)
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Декапептил, 0,1 мг/мл, раствор для подкожного введения.
Действующее вещество: трипторелина ацетат.
1 шприц с препаратом содержит 100 мкг трипторелина ацетат в пересчете на трипторелин (основание) 95,6 мкг.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий (см. раздел 4.4.).
Полный перечень вспомогательных веществ приведен в разделе 6.1.
Раствор для подкожного введения.
Прозрачный бесцветный раствор без запаха.
4.1. Показания к применению
Препарат Декапептил показан женщинам в возрасте 18 лет и старше для снижения и предупреждения повышения концентрации лютеинизирующего гормона (ЛГ) при лечении бесплодия с использованием вспомогательных репродуктивных технологий (ЭКО и ПЭ - экстракорпоральное оплодотворение и перенос эмбрионов в полость матки) в циклах с применением фолликулостимулирующего гормона (ФСГ) и человеческого менопаузального гонадотропина (чМГ).
4.2. Режим дозирования и способ применения
Терапию препаратом Декапептил следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия.
Режим дозирования
Препарат вводят подкожно по 0,1 мг ежедневно, начиная со 2-3 дня цикла (в коротком протоколе), на 2 день цикла или на 21-25 день предшествующего менструального цикла (в длинном протоколе). Длительность терапии зависит от используемого протокола и определяется врачом индивидуально. Инъекции препарата Декапептил прекращают за 24 часа до предполагаемого введения препарата человеческого хорионического гонадотропина (чХГ).
Короткий протокол – по 0,1 мг в течение 10-12 дней. Со 2-3 дня цикла начинают индукцию овуляции, продолжая вводить Декапептил в дозе 0,1 мг.
Длинный протокол – ежедневные подкожные инъекции препарата Декапептил 0,1 мг начинают со 2-го или с 21-25 дня менструального цикла, предшествующего лечебному. При достижении стойкой супрессии эстрадиола (Е2 < 50 пг/мл), обычно на 15 день терапии, начинают стимуляцию гонадотропинами и продолжают инъекции препарата Декапептил в дозе 0,1 мг, заканчивая за 24 часа до запланированного введения чХГ.
Контролируемую гиперстимуляцию яичников гонадотропинами следует начинать через 2-4 недели после начала лечения препаратом Декапептил. Необходимо проводить мониторинг ответа яичников на проводимую терапию на основании результатов ультразвукового исследования (УЗИ) и в сочетании с определением концентрации эстрадиола в плазме крови и, при необходимости, корректировать дозу гонадотропинов. При достижении адекватного ответа яичников (размер и количество фолликулов) следует прекратить применение препарата Декапептил и гонадотропинов и однократно ввести чХГ для индукции овуляции. Если через 4 недели не достигается необходимый терапевтический ответ и происходит отторжение эндометрия (определяется методом УЗИ и в сочетании с определением концентрации эстрадиола), следует рассмотреть вопрос о прекращении лечения препаратом Декапептил. Общая продолжительность лечения составляет от 4 до 7 недель. При применении препарата необходимо наблюдать за протеканием секреторной фазы менструального цикла пациентки в соответствии с утвержденными схемами лечения.
Особые группы пациентов
Пациенты с нарушениями функции почек и/или печени
Не требуется коррекция дозы при применении препарата Декапептил у пациентов с нарушениями функции почек или печени. Согласно результатам клинического исследования, риск кумуляции трипторелина у пациентов данной группы является незначительным (см. раздел 5.2).
Способ применения
Препарат вводится подкожно 1 раз в день в нижнюю часть брюшной стенки. После первой инъекции рекомендуется наблюдать за пациентом на протяжении 30 минут для выявления симптомов развития аллергических/псевдоаллергических реакций. Введение препарата и последующее наблюдение должно осуществляться в условиях, обеспечивающих возможность быстрого оказания помощи при развитии гиперчувствительности. Если нет признаков повышенной чувствительности, последующие инъекции могут выполняться самими пациентами при условии информирования о признаках развития аллергических реакций и их последствиях. Однако в случае возникновения аллергической реакции необходимо немедленно обратиться за медицинской помощью.
4.3. Противопоказания
4.4. Особые указания и меры предосторожности при применении
Особые указания
Профилактика липодистрофии
Для профилактики липодистрофии следует постоянно менять место введения препарата.
Аденома гипофиза
В редких случаях терапия агонистами ГнРГ может выявить наличие ранее не диагностированной гонадотропиномы (гонадотропин-секретирующая аденома гипофиза). У таких пациентов может развиваться кровоизлияние в гипофиз, характеризующееся внезапной головной болью, рвотой, нарушением зрения и офтальмоплегией.
Депрессия
У пациентов, получающих терапию агонистами ГнРГ, такими как трипторелин, наблюдается повышенный риск развития депрессивных состояний (которые могут быть тяжелыми). Сообщалось о случаях эмоциональной лабильности, включая депрессию. Пациенты должны быть проинформированы, и при необходимости должно быть назначено соответствующее лечение.
Пациенты с диагностированными депрессивными состояниями должны находиться под медицинским наблюдением во время терапии трипторелином.
Уменьшение минеральной плотности костей
Применение агонистов ГнРГ может приводить к уменьшению минеральной плотности костей (МПК). С особой осторожностью следует применять препарат у пациентов с дополнительными факторами риска развития остеопороза (например, хронический алкоголизм, курение, длительная терапия препаратами, уменьшающими МПК, такими как противосудорожные препараты или глюкокортикостероиды, остеопороз в семейном анамнезе, нарушения питания).
Потеря минеральной плотности костей
Применение агонистов ГнРГ в течение 6-месячного курса лечения, вероятно, может вызвать уменьшение МПК в среднем на 1% в месяц. Снижение МПК на каждые 10% увеличивает риск переломов в 2-3 раза.
Имеющиеся данные свидетельствуют о том, что у большинства женщин восстановление костной массы происходит после прекращения лечения.
Отсутствуют данные о применении препарата у пациентов с тяжелым остеопорозом или с высокими факторами риска возникновения остеопороза (например, хронический алкоголизм, курение, длительная терапия препаратами, уменьшающими МПК, такими как противосудорожные препараты или кортикостероиды, остеопороз в семейном анамнезе, нарушения питания, например, нервная анорексия). Поскольку для данной группы пациентов уменьшение МПК опаснее, решение о лечении трипторелином следует принимать в индивидуальном порядке после полного обследования и только в случае, если ожидаемая польза лечения превышает возможный риск. При этом следует применять дополнительные меры для предотвращения уменьшения МПК.
Нарушение функции печени и почек
У пациенток с нарушениями функции почек и/или печени конечный период полувыведения трипторелина составляет 7-8 часов по сравнению с 3-5 часами у здоровых пациентов. Несмотря на более продолжительное действие, ожидается, что трипторелин выводится до момента переноса эмбрионов.
Аллергические реакции
С особой осторожностью следует применять препарат у женщин с признаками аллергических реакций или склонностью к аллергическим реакциям в анамнезе. Не рекомендуется применять трипторелин у женщин с тяжелыми аллергическими реакциями.
Беременность
Необходимо проводить тщательное обследование женщин репродуктивного возраста до начала лечения, чтобы исключить возможность беременности.
Применение вспомогательных репродуктивных технологий (ВРТ) связано с повышенным риском многоплодной беременности, внутриутробной гибели плода в период беременности, эктопической беременности и развития врожденных пороков развития. Эти риски сохраняются в случае применения трипторелина в качестве вспомогательной терапии во время контролируемой гиперстимуляции яичников.
Синдром гиперстимуляции яичников (СГЯ)
Стимуляцию яичников необходимо осуществлять под тщательным медицинским наблюдением.
Применение трипторелина во время контролируемой гиперстимуляции яичников может повысить риск развития СГЯ и кист яичников. Стимуляция фолликулов, вызванная применением аналогов ГнРГ и гонадотропинов, может заметно усиливаться у небольшого количества пациенток, особенно при предрасположенности или при синдроме поликистозных яичников (СПКЯ).
Как и у других аналогов ГнРГ, сообщалось о случаях развития СГЯ при применении трипторелина в сочетании с гонадотропинами.
СГЯ – синдром, отличный от неосложненного увеличения яичников, проявляется более выраженной степенью тяжести. Он включает в себя значительное увеличение яичников, высокую концентрацию эстрогенов в плазме крови, а также увеличение проницаемости сосудов. Последнее может привести к накоплению жидкости в брюшной, плевральной и, реже, перикардиальной полостях.
При СГЯ тяжелой степени наблюдаются следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и желудочно-кишечные симптомы, включая тошноту, рвоту и диарею. При клиническом обследовании могут быть выявлены гиповолемия, гемоконцентрация, электролитные нарушения, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острый респираторный дистресс-синдром и тромбоэмболические осложнения.
Чрезмерная реакция яичников на введение гонадотропинов редко приводит к развитию СГЯ, если не вводится чХГ с целью стимуляции овуляции. Поэтому в случае гиперстимуляции яичников не следует вводить чХГ, а пациентку следует предупредить о необходимости воздерживаться от половых контактов или использовать барьерные методы контрацепции не менее 4 дней. СГЯ может быстро прогрессировать (в течение от 24 ч до нескольких дней), становясь серьезным медицинским осложнением. В связи с вышеизложенным, пациентки должны наблюдаться, по крайней мере, в течение 2-х недель после введения чХГ.
СГЯ может быть более тяжелым и затяжным в случае наступления беременности. Чаще всего СГЯ развивается после прекращения лечения гонадотропинами, достигает максимума тяжести в течение 7-10 дней после окончания лечения. Обычно СГЯ проходит спонтанно после начала менструации.
При развитии СГЯ тяжелой степени терапию прекращают, пациентку госпитализируют и начинают специфическую терапию.
Развитие СГЯ более характерно для пациенток с СПКЯ.
Риск развития СГЯ может повышаться при применении агонистов ГнРГ в сочетании с гонадотропинами в сравнении с применением только гонадотропинов.
Кисты яичников
На начальном этапе лечения агонистами ГнРГ могут образовываться кисты яичников. Обычно они бессимптомные и нефункциональные.
Вспомогательные вещества
Препарат Декапептил содержит натрий, менее 1 ммоль (23 мг) натрия в максимальной дозе препарата, то есть, по сути, не содержит натрия.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Исследования взаимодействия трипторелина с другими лекарственными препаратами не проводились.
Нельзя исключать вероятность взаимодействия с лекарственными средствами, высвобождающими гистамин.
Поскольку проведение антиандрогенной терапии может вызвать удлинение интервала QT, следует с осторожностью применять трипторелин с лекарственными препаратами, удлиняющими интервал QT, или с лекарственными препаратами, индуцирующими развитие желудочковой тахикардии типа «пируэт», такими как антиаритмические средства класса IA (хинидин, дизопирамид), или класса III (амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, нейролептики и прочие препараты с указанным действием.
Следует проявлять осторожность при одновременном применении трипторелина с лекарственными препаратами, действующими на секрецию гонадотропинов; при этом рекомендуется контролировать содержание гормонов у пациентов.
4.6. Фертильность, беременность и лактация
Беременность
Трипторелин противопоказан к применению во время беременности. Перед началом лечения необходимо подтвердить отсутствие беременности. При применении трипторелина рекомендуется использовать барьерные методы контрацепции до наступления менструации. При наступлении беременности во время лечения терапию трипторелином необходимо прекратить.
Связь применения трипторелина и развития аномалий ооцитов или плода при беременности не установлена.
Данные о влиянии трипторелина на повышение риска возникновения внутриутробных пороков развития при беременности ограничены. В ходе доклинических исследований была выявлена репродуктивная токсичность. На основании данных о фармакологическом действии трипторелина нельзя исключить возможность неблагоприятного воздействия трипторелина на течение беременности и развитие плода.
Лактация
Применение трипторелина противопоказано в период грудного вскармливания. В связи с потенциальным развитием нежелательных реакций у детей рекомендуется прекратить грудное вскармливание до начала лечения и до окончания лечения.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Исследования влияния трипторелина на способность управлять транспортными средствами и работать с механизмами не проводились. Трипторелин не оказывает отрицательного воздействия на способность управлять транспортными средствами и другими механизмами.
4.8. Нежелательные реакции
Резюме профиля безопасности
В таблице ниже приведены нежелательные реакции (НР), о которых часто (≥ 2%) сообщалось во время лечения пациентов трипторелином в ходе клинических исследований, как до применения гонадотропинов, так и параллельно с ними. К наиболее частым НР относились головная боль (27%), кровотечение из половых путей (24%), боль в животе (15%), покраснение в месте инъекции (12%) и тошнота (10%).
Могут наблюдаться «приливы» разной интенсивности, от легких до выраженных, а также повышенное потоотделение, что обычно не требует прекращения лечения.
В начале лечения применение трипторелина в сочетании с гонадотропинами может привести к развитию СГЯ (см. раздел 4.4). При этом может наблюдаться увеличение размера яичников, одышка, боль в животе. В начале лечения могут возникать кровотечения – меноррагия и метроррагия.
Сообщалось о частых случаях (1%) развития кист яичников на начальном этапе лечения трипторелином.
Во время лечения трипторелином определенные НР указывали на общую картину снижения концентрации половых гормонов в крови, связанных с гипофизарно-овариальной блокадой, таких как нарушения сна, головная боль, эмоциональная лабильность, сухость слизистой влагалища, боли во время полового акта и снижение либидо.
Во время лечения трипторелином может наблюдаться боль в молочных железах, мышечные спазмы, артралгия, увеличение массы тела, тошнота, боль и дискомфорт в животе, астения и нарушения четкости зрения.
Сообщалось о единичных случаях местных или генерализованных аллергических реакций после инъекций трипторелина.
Табличное резюме нежелательных реакций
Частота НР: очень часто (≥ 1/10), часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), частота не установлена (в настоящее время данные о распространенности НР отсутствуют).
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Частота не установлена |
|
Инфекции и инвазии |
|
Инфекция верхних дыхательных путей, фарингит |
|
|
|
Нарушения со стороны иммунной системы |
|
|
|
Гиперчувствительность |
|
Психические нарушения |
|
|
Эмоциональная лабильность, депрессия |
Нарушение сна, снижение либидо |
|
Нарушения со стороны нервной системы |
Головная боль |
Головокружение |
|
|
|
Нарушения со стороны органа зрения |
|
|
|
Нарушение зрения, снижение четкости зрения |
|
Нарушения со стороны сосудов |
|
«Приливы» |
|
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
|
Одышка |
|
Желудочно-кишечные нарушения |
Боль в животе, тошнота |
Вздутие живота, рвота |
|
Дискомфорт в животе |
|
Нарушения со стороны кожи и подкожных тканей |
|
|
|
Повышенное потоотделение, зуд, сыпь, ангионевротический отек, крапивница |
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
|
Боль в спине |
|
Мышечные спазмы, артралгия |
|
Беременность, послеродовой период и перинатальные состояния |
|
Самопроизвольный аборт |
|
|
|
Нарушения со стороны репродуктивной системы и молочных желез |
Кровотечение из половых путей
|
Тазовая боль, СГЯ, дисменорея, образование кисты яичника |
|
Увеличение яичника, меноррагия, метроррагия, сухость слизистой влагалища и вульвы, боли при половом акте, боль в молочной железе |
|
Общие нарушения и реакции в месте введения |
Покраснение в месте инъекции |
Боль в месте инъекции, инфекции в месте инъекции, утомляемость, гриппоподобное заболевание |
|
Астения, эритема в месте инъекции |
|
Лабораторные и инструментальные данные |
|
|
|
Увеличение массы тела |
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
|
Российская Федерация Федеральная служба по надзору в сфере здравоохранения Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1 Телефон: +7 800 550 99 03 Электронная почта: pharm@roszdravnadzor.gov.ru Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.roszdravnadzor.gov.ru/ |
|
Республика Беларусь Адрес: 220037, Минск, Товарищеский пер., 2a Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» Телефон: +375-17-299-55-14 Факс: +375-17-299-53-58 Электронная почта: rcpl@rceth.by Сайт: http://www.rceth.by/ |
|
Республика Казахстан Адрес: 010000, г. Нур-Султан, пр. Мәңгілік Ел, 20 РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета контроля качества и безопасности товаров и услуг Министерства здравоохранения Республики Казахстан Телефон: 8 (7172) 78-98-28 Электронная почта: farm@dari.kz Сайт: http://www.ndda.kz/ |
|
Республика Армения Адрес: 0051, г. Ереван, пр. Комитаса 49/4 «Научный Центр экспертизы лекарств и медицинских технологий им. академика Э. Габриеляна» АОЗТ Телефон: (+374 10) 23 08 96, (+374 60) 83-00-73 Электронная почта: vigilance@pharm.am Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.pharm.am/ |
4.9. Передозировка
Симптомы
Передозировка может возникнуть при применении трипторелина, длительность которого превышает рекомендуемую. Передозировка может вызвать более длительный период действия препарата. При передозировке не наблюдалось развития нежелательных реакций.
Лечение
При возникновении передозировки необходимо временно прекратить применение трипторелина.
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: противоопухолевые гормональные препараты и антагонисты гормонов; гормоны и родственные соединения; аналоги гонадотропин-рилизинг гормона.
Код АТХ: L02AE04.
Механизм действия
Действующее вещество трипторелин – синтетический декапептидный аналог гонадотропин-рилизинг гормона (ГнРГ), синтезируемого в гипоталамусе. Трипторелин обладает более длительным действием, чем ГнРГ. Его действие осуществляется в два этапа. Сразу после введения трипторелин вызывает повышение концентрации ФСГ и ЛГ в крови, что приводит к кратковременному повышению концентрации эстрогенов у женщин. Продолжительная стимуляция гипофиза (в случае постоянной концентрации трипторелина в крови) приводит к блокаде гонадотропной функции, результатом чего является снижение концентрации половых гормонов в крови и подавление функции яичников.
Фармакодинамические эффекты
Угнетение функции гипофиза длится не менее 6 дней после последнего введения трипторелина. После прекращения лечения трипторелином наблюдается дальнейшее снижение концентрации ЛГ, при этом возвращение концентрации ЛГ к исходному значению наблюдается через 2 недели.
Ингибирование трипторелином гонадотропной функции гипофиза предупреждает повышение концентрации ЛГ, вследствие чего не происходит преждевременная овуляция и/или лютеинизация фолликула. В результате применения агонистов ГнРГ снижается частота прерывания цикла экстракорпорального оплодотворения (ЭКО), данная терапия позволяет повысить частоту наступления беременности при проведении вспомогательных репродуктивных технологий (ВРТ).
5.2. Фармакокинетические свойства
Абсорбция
В первые часы после введения трипторелина регистрируется максимальная концентрация трипторелина в крови. Системная биодоступность трипторелина после подкожного введения составляет около 100%.
Биотрансформация
Метаболизм трипторелина до более простых пептидов и аминокислот происходит, в основном, в печени и почках.
Элиминация
Трипторелин выводится из организма в течение 24 часов, соответственно на момент переноса эмбриона не будет определяться в плазме крови. Период полувыведения трипторелина из плазмы крови около 18,7 мин, при этом для природного ГнРГ этот показатель составляет около 7,7 мин. Клиренс трипторелина (503 мл/мин) в 3 раза ниже, чем у природного ГнРГ (1766 мл/мин), и состоит из двух компонентов - быстрого и медленного выведения.
Трипторелин выводится преимущественно почками, менее 4% - в неизменном виде. Период полувыведения составляет 3-5 ч.
Почечная и/или печеночная недостаточность
Было установлено, что у пациентов с тяжелыми нарушениями функции почек и печени возможна кумуляция незначительного количества трипторелина в организме и увеличение периода полувыведения (около 8 ч).
6.1. Перечень вспомогательных веществ
Натрия хлорид
Вода для инъекций
Кислота уксусная ледяная
6.2. Несовместимость
В связи с отсутствием исследований совместимости данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
6.3. Срок годности (срок хранения)
3 года.
6.4. Особые меры предосторожности при хранении
Хранить при температуре 2–8 °С в оригинальной упаковке для защиты от света.
Не замораживать.
6.5. Характер и содержание первичной упаковки
По 1 мл в одноразовый стеклянный шприц с иглой с защитным колпачком.
По 7 шприцев в пластиковой ячейковой упаковке в картонной пачке с листком-вкладышем.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Все содержимое предварительно заполненного одноразового шприца с препаратом следует вводить подкожно. Только для однократного применения.
Особые требования к утилизации отсутствуют.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Германия
Ферринг ГмбХ
Витланд 11, 24109 Киль.
Тел.: + 49 431 5852 0.
Факс: + 49 431 5852 35.
Электронная почта: production@ferring.com
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
В Российской Федерации, в Республике Беларусь, в Республике Армения:
Российская Федерация
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб., д. 52, стр. 4.
Тел.: +7 (495) 287-0343.
Факс: +7 (495) 287-0342.
Электронная почта: Safety.MailboxRussia@ferring.com
В Республике Казахстан:
Республика Казахстан
Представительство «Ферринг Фармацевтикалс СА»
050022, г. Алматы, ул. Наурызбай батыра, 99/1, н.п. 41Б.
Тел.: +7 (727) 311-54-47.
Факс: +7 (727) 311-54-47.
Электронная почта: Safety.MailboxRussia@ferring.com
Дата первой регистрации: 9 октября 2023г.
Общая характеристика лекарственного препарата Декапептил доступна на информационном портале Евразийского экономического союза в информационно-телекоммуникационной сети «Интернет» http://eec.eaeunion.org/.
МЕНОПУР® (менотропины)
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Менопур, 75 МЕ ФСГ+75 МЕ ЛГ, лиофилизат для приготовления раствора для внутримышечного и подкожного введения
Действующее вещество: менотропины*.
Каждый флакон содержит менотропины (человеческий менопаузальный гонадотропин высокоочищенный, чМГ) – 75 МЕ фолликулостимулирующего гормона (ФСГ) + 75 МЕ лютеинизирующего гормона (ЛГ).
* Получено из мочи женщин в период постменопаузы.
Полный перечень вспомогательных веществ указан в разделе 6.1.
Лиофилизат для приготовления раствора для внутримышечного и подкожного введения.
Лиофилизат: белая или почти белая лиофилизированная масса.
Растворитель: бесцветный прозрачный раствор.
4.1. Показания к применению
Препарат Менопур показан для лечения взрослых пациентов.
У женщин
У мужчин
4.2. Режим дозирования и способ применения
Лечение препаратом Менопур следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия.
Режим дозирования
Доза препарата, описанная ниже, является одинаковой как для подкожного (п/к), так и для внутримышечного (в/м) способа введения. Установлено, что яичники неодинаково реагируют на введение гонадотропинов. По этой причине невозможно разработать универсальную схему дозирования. Доза должна подбираться индивидуально в зависимости от реакции яичников. Препарат Менопур применяют в виде монотерапии или в комбинации с агонистами или антагонистами гонадотропин-рилизинг-гормона (ГнРГ). Рекомендуемые дозы и продолжительность терапии зависят от применяемой схемы лечения.
У женщин
Ановуляция (включая СПКЯ)
Целью лечения препаратом Менопур является развитие одного зрелого фолликула, из которого после введения препаратов хорионического гонадотропина человека (чХГ) выйдет ооцит.
Лечение обычно начинают в первые 7 дней менструального цикла. Рекомендуемая начальная доза препарата Менопур составляет 75–150 МЕ в сутки в течение не менее 7 дней. Дальнейшую схему лечения подбирают после мониторинга ответа яичников на проводимую терапию на основании результатов ультразвукового исследования (УЗИ) в сочетании с определением концентрации эстрадиола в плазме крови. При отсутствии реакции яичников доза увеличивается на 37,5 МЕ (одно введение) не чаще 1 раза в неделю, каждое последующее повышение не должно превышать 75 МЕ. Максимальная суточная доза не должна превышать 225 МЕ. Если терапевтический ответ не достигнут в течение 4 недель, следует прекратить лечение и начать новый цикл с более высоких начальных доз.
При достижении адекватного ответа яичников на следующий день после последней инъекции препарата Менопур однократно вводят 5000–10000 МЕ чХГ для индукции овуляции. Пациентке рекомендуется иметь половые контакты в день введения чХГ и на следующий день после введения. В качестве альтернативного метода возможно проведение внутриматочной инсеминации. Пациентка должна находиться под постоянным наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции яичников на введение препарата Менопур курс терапии необходимо прекратить и отказаться от введения чХГ. Пациентке рекомендуется использовать барьерные методы контрацепции или воздержание от половых контактов до наступления менструации.
Контролируемая гиперстимуляция яичников с целью индукции роста множественных фолликулов при проведении ВРТ
Согласно протоколу с применением агонистов ГнРГ в соответствии с принципом обратной связи, терапию препаратом Менопур следует назначать примерно через 2 недели после начала введения агонистов ГнРГ. В протоколе стимуляции овуляции с применением антагонистов ГнРГ введение препарата Менопур следует начинать на 2 или 3 день менструального цикла. Рекомендуемая начальная суточная доза препарата Менопур составляет 150–225 МЕ в течение не менее 5 первых дней лечения. Дальнейшую схему лечения подбирают после мониторинга ответа яичников на проводимую терапию на основании результатов УЗИ в сочетании с определением концентрации эстрадиола в плазме крови. Рекомендуемая повышающая доза не должна превышать 150 МЕ. Максимальная суточная доза препарата Менопур не должна превышать 450 МЕ. Общая продолжительность терапии не должна превышать 20 дней.
При достижении оптимальной реакции яичников после последней инъекции препарата Менопур назначается одна инъекция чХГ в дозе 10000 МЕ для индукции окончательного созревания фолликулов и индукции выхода ооцита. Пациентка должна находиться под постоянным наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции яичников на введение препарата Менопур курс терапии необходимо прекратить и отказаться от введения чХГ. Пациентке рекомендуется использовать барьерные методы контрацепции или воздержание от половых контактов до наступления менструации.
У мужчин
У мужчин для стимуляции сперматогенеза при гипогонадотропном гипогонадизме препарат Менопур рекомендуется применять в дозе от 75 МЕ до 150 МЕ 3 раза в неделю вместе с инъекциями чХГ в дозе 1500 МЕ 3 раза в неделю, если предшествующая терапия препаратами чХГ (введение 1500–5000 МЕ чХГ 3 раза в неделю) на протяжении 4–6 месяцев привела к нормализации концентрации тестостерона в плазме крови. Лечение по этой схеме следует продолжать не менее 4 месяцев до улучшения сперматогенеза. При отсутствии положительного эффекта в течение этого времени комбинированная терапия может быть продолжена до получения положительного результата терапии. Согласно исследованиям, для улучшения сперматогенеза может понадобиться не менее 18 месяцев лечения.
Применение в особых клинических группах пациентов
У пациентов с почечной и/или печеночной недостаточностью
Клинические исследования у пациентов с почечной и/или печеночной недостаточностью не проводились.
Дети
Показания к применению препарата Менопур у детей и подростков в возрасте до 18 лет отсутствуют.
Способ применения
Препарат Менопур вводится в/м или п/к после растворения лиофилизата во входящем в комплект растворителе.
Рекомендации по приготовлению раствора и общие указания приведены в разделе 6.6.
4.3. Противопоказания
У женщин:
У мужчин:
4.4. Особые указания и меры предосторожности при применении
С осторожностью
У женщин – наличие факторов риска развития тромбоэмболических осложнений (индивидуальная или семейная предрасположенность, ожирение с индексом массы тела (ИМТ) > 30 кг/м2, тромбофилия); заболевания маточных труб в анамнезе.
Препарат Менопур обладает выраженной гонадотропной активностью, в связи с чем при применении препарата могут развиваться нежелательные реакции (НР) разной степени тяжести. Лечение должно проводиться под наблюдением врача, имеющего опыт диагностики и лечения бесплодия!
Применение гонадотропинов требует присутствия квалифицированного медицинского персонала, а также соответствующего оборудования. Перед назначением препарата Менопур и в процессе лечения следует контролировать состояние яичников (УЗИ и концентрация эстрадиола в плазме крови). Необходимо применять препарат в наиболее низкой эффективной дозе, отвечающей целям лечения.
Первая инъекция препарата должна выполняться под непосредственным наблюдением врача.
Женщины
Перед началом применения препарата Менопур рекомендуется проведение диагностики причин бесплодия как у женщины, так и у ее партнера, а также установить возможные противопоказания к беременности. Перед началом лечения необходимо провести обследование женщин на наличие гипотиреоза, недостаточности надпочечников, гиперпролактинемии, опухоли гипоталамо-гипофизарной области и при необходимости провести соответствующее лечение.
Проведение контролируемой стимуляции роста фолликулов, вне зависимости от показания к применению у женщин, может привести к увеличению яичников с развитием их гиперстимуляции.
При соблюдении режима дозирования и способа введения препарата в сочетании с мониторингом проводимой терапии, возможно минимизировать риск возникновения вышеуказанных реакций.
Оценка развития фолликула должна проводиться врачом, имеющим соответствующий опыт.
Синдром гиперстимуляции яичников
Синдром гиперстимуляции яичников (СГЯ) – синдром, отличный от неосложненного увеличения яичников, проявления которого зависят от степени тяжести. Он включает в себя значительное увеличение яичников, высокую концентрацию эстрогенов в плазме крови, а также увеличение проницаемости сосудов, что может привести к накоплению жидкости в брюшной, плевральной и, реже, перикардиальной полости.
В тяжелых случаях СГЯ возможны следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и симптомы со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При клиническом обследовании возможно выявление гиповолемии, гемоконцентрации, электролитных нарушений, асцита, гемоперитонеума, экссудативного плеврита, гидроторакса, острого респираторного дистресс-синдрома и тромбоэмболических осложнений.
Чрезмерная реакция яичников на введение гонадотропинов редко приводит к развитию СГЯ, если не вводится чХГ с целью стимуляции овуляции. Поэтому в случае гиперстимуляции яичников не следует вводить чХГ, а пациентку следует предупредить о необходимости воздерживаться от половых контактов или использовать барьерные методы контрацепции не менее 4 дней. СГЯ может быстро прогрессировать (в течение от 24 ч до нескольких дней), становясь серьезным ятрогенным осложнением, поэтому необходимо тщательное наблюдение за пациентками, по крайней мере, в течение не менее 2-х недель после введения чХГ.
Соблюдение рекомендованных доз препарата Менопур, режима введения и тщательный контроль терапии может свести к минимуму случаи гиперстимуляции яичников и многоплодной беременности. При проведении ВРТ аспирация содержимого всех фолликулов до наступления овуляции может снизить риск развития СГЯ.
СГЯ может быть более тяжелым и затяжным при развитии беременности. Чаще всего СГЯ развивается после прекращения лечения гонадотропинами и достигает максимума тяжести через 7–10 дней после окончания лечения. Обычно СГЯ проходит спонтанно после начала менструации.
При развитии СГЯ тяжелой степени лечение прекращают, пациентку госпитализируют и начинают специфическую терапию.
Развитие СГЯ более характерно для пациенток с СПКЯ.
Многоплодная беременность
При многоплодной беременности отмечается повышенный риск неблагоприятных материнских и перинатальных исходов.
При применении менотропинов многоплодная беременность развивается чаще, чем при естественном зачатии. Отмечается наиболее высокая частота рождения двойни. Для уменьшения риска многоплодной беременности рекомендуется тщательный мониторинг ответа яичников на стимуляцию.
В случае проведения ВРТ вероятность возникновения многоплодной беременности зависит от числа введенных эмбрионов, их качества и возраста пациентки.
Пациентка должна быть предупреждена о потенциальном риске многоплодной беременности до начала лечения бесплодия.
Осложнения беременности
Частота самопроизвольных абортов и преждевременных родов при беременности, наступившей после лечения препаратом Менопур, выше, чем у здоровой женщины.
Эктопическая беременность
У пациенток с заболеваниями маточных труб в анамнезе, как при естественном зачатии, так и при лечении бесплодия, имеется высокий риск возникновения эктопической беременности. Распространенность внематочной беременности после ЭКО составляет от 2 до 5% по сравнению с 1 до 1,5% в общей популяции.
Новообразования органов репродуктивной системы
Имеются сообщения о новообразованиях яичников и других органов репродуктивной системы, как доброкачественных, так и злокачественных, у женщин, неоднократно получавших препараты для лечения бесплодия. В настоящее время не установлено, увеличивает ли лечение гонадотропинами исходный риск этих опухолей у женщин с бесплодием.
Врожденные пороки развития
Распространенность врожденных пороков развития плода при использовании ВРТ несколько выше, чем при естественном зачатии. Считается, что это может быть связано с индивидуальными особенностями родителей (возрастом матери, характеристиками спермы) и многоплодной беременностью.
Тромбоэмболические осложнения
Женщины с известными факторами риска развития тромбоэмболических осложнений, такими как индивидуальная или семейная предрасположенность, ожирение (ИМТ > 30 кг/м2) или тромбофилия, могут иметь повышенный риск венозных или артериальных тромбоэмболических осложнений во время или после лечения гонадотропинами. В таких случаях польза их применения должна быть сопоставлена с возможным риском. Следует учитывать, что сама беременность также повышает риск развития тромбоэмболических осложнений.
Мужчины
Применение препарата Менопур у мужчин с высокой концентрацией ФСГ неэффективно. Для оценки эффективности лечения проводят анализ спермы через 4–6 месяцев после начала лечения.
Вспомогательные вещества
Препарат Менопур содержит менее 1 ммоль натрия (23 мг) на дозу, что позволяет расценивать препарат как практически не содержащий натрия.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Исследование лекарственных взаимодействий препарата Менопур не проводилось.
Одновременное применение менотропинов с кломифеном может усилить стимуляцию роста фолликулов, несмотря на отсутствие клинических данных о совместном применении этих препаратов. Совместное применение с агонистами ГнРГ может потребовать увеличения дозы менотропинов для достижения оптимальной реакции яичников.
4.6. Фертильность, беременность и лактация
Применение препарата Менопур противопоказано во время беременности и в период грудного вскармливания.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Исследования влияния менотропинов на способность управлять транспортными средствами и механизмами не проводились. Маловероятно, что препарат Менопур оказывает отрицательное воздействие на способность управлять транспортными средствами и другими механизмами.
4.8. Нежелательные реакции
Резюме профиля безопасности
Наиболее серьезными и частыми НР, выявленными при применении препарата Менопур в клинических исследованиях с частотой до 5%, были СГЯ, боль в животе, головная боль, вздутие живота и боль в месте инъекции.
Табличное резюме нежелательных реакций
Частота НР: часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), редко (≥ 1/10000 до <1/1000), частота неизвестна (в настоящее время данные о распространенности НР отсутствуют, зарегистрированы в период пострегистрационного применения препарата).
Основные НР, выявленные в клинических исследованиях и в ходе пострегистрационного применения, приведены ниже в таблице.
|
Системно-органный класс |
Часто (≥1/100, <1/10) |
Нечасто (≥1/1000, <1/100) |
Редко (≥1/10000, <1/1000) |
Частота неизвестна |
|
Нарушения со стороны иммунной системы |
|
|
|
Реакции гиперчувствительности* |
|
Нарушения со стороны нервной системы |
Головная боль |
Головокружение |
|
|
|
Нарушения со стороны органа зрения |
|
|
|
Преходящая слепота, диплопия, мидриаз, скотома, фотопсия, преходящее помутнение стекловидного тела, снижение четкости зрения |
|
Нарушения со стороны сосудов |
|
«Приливы» жара |
|
Венозные и артериальные тромбоэмболии (как правило, при СГЯ) |
|
Нарушения со стороны желудочно-кишечного тракта |
Боль в животе, вздутие живота, тошнота, увеличение живота в объеме |
Рвота, дискомфорт в животе, диарея |
|
|
|
Нарушения со стороны кожи и подкожных тканей |
|
|
Угревая сыпь, кожные высыпания |
Кожный зуд, крапивница |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|
|
|
Боль в суставах, боль в спине и шее, боль в конечностях |
|
Нарушения со стороны половых органов и молочной железы |
СГЯ**, тазовая боль*** |
Кисты яичников, нарушения со стороны молочных желез**** |
|
Перекрут яичника** |
|
Общие расстройства и нарушения в месте введения |
Боль в месте инъекции |
Повышенная утомляемость |
|
Повышение температуры тела, недомогание |
|
Лабораторные и инструментальные данные |
|
|
|
Увеличение массы тела |
* Отмечались редкие случаи местных или общих аллергических реакций, в т.ч. случаи анафилактических реакций.
** В клинических исследованиях отмечались связанные с развитием СГЯ нарушения со стороны желудочно-кишечного тракта, такие как вздутие и дискомфорт в животе, тошнота, рвота и диарея. В случаях тяжелого СГЯ в качестве редких осложнений возможно развитие асцита и скопления жидкости в полости таза, экссудативного плеврита, одышки, олигурии, тромбоэмболических осложнений и перекрута яичника.
*** Боль в области придатков матки.
**** Боль и дискомфорт в молочных железах, нагрубание и отечность молочных желез, боль в сосках.
При применении менотропинов у мужчин были отмечены случаи гинекомастии, акне и увеличения массы тела.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
|
Российская Федерация Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1 Федеральная служба по надзору в сфере здравоохранения Российской Федерации Телефон: +7 (495) 698–45–38, +7 (499) 578–02–20 Электронная почта: pharm@roszdravnadzor.gov.ru |
4.9. Передозировка
Случаи передозировки при применении препарата Менопур неизвестны, однако в таких ситуациях следует ожидать развитие СГЯ (см. раздел 4.4).
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: гонадотропины и другие стимуляторы овуляции.
Код АТХ: G03GA02.
Механизм действия, фармакодинамические эффекты
Действующим веществом препарата Менопур является чМГ высокой степени очистки, получаемый из мочи женщин в период постменопаузы. Препарат содержит ФСГ и ЛГ.
Органами-мишенями для гормонального эффекта чМГ у женщин являются яичники. чМГ стимулирует гаметогенез и синтез половых гормонов.
ФСГ является ключевым фактором роста и развития фолликулов на стадии раннего фолликулогенеза. ЛГ играет важную роль в продукции половых гормонов яичниками и вовлечен в физиологические процессы, приводящие к развитию полноценного преовуляторного фолликула. Стимуляция фолликулярного роста под действием ФСГ, в случае полного отсутствия ЛГ, завершается патологическим развитием фолликула, ассоциированным с низкой концентрацией эстрадиола и неспособностью к лютеинизации неовулирующего фолликула в ответ на нормальный овуляторный стимул.
Принимая во внимание действие ЛГ, заключающееся в усилении синтеза половых гормонов, применение препарата Менопур в циклах ЭКО/ИКСИ связано с более высокой концентрацией эстрадиола в плазме крови, чем при применении препаратов рекомбинантного ФСГ. Данный аспект следует учитывать при контроле ответа на применение препарата по динамике изменения концентрации эстрадиола. Различия в концентрации эстрадиола в протоколах при применении низких доз препарата для индукции овуляции у пациенток с ановуляторным циклом не обнаружены.
Органами-мишенями для гормонального эффекта чМГ у мужчин являются яички. В яичках ФСГ индуцирует созревание клеток Сертоли, что преимущественно оказывает влияние на деление клеток извитых канальцев и развитие сперматозоидов. При этом необходима высокая внутритестикулярная концентрация андрогенов, которая достигается предшествующей терапией чХГ.
5.2. Фармакокинетические свойства
Был установлен фармакокинетический профиль ФСГ, входящего в состав препарата Менопур.
Абсорбция и распределение
Максимальная концентрация (Сmaх) ФСГ в плазме крови достигается в течение 7 ч после п/к или в/м введения. Объем распределения, определяемый у здоровых женщин-добровольцев со сниженным количеством рецепторов, после введения повторных доз 150 МЕ в течение 7 дней составляет 8,9 ± 3,5 МЕ/л.
Элиминация
Период полувыведения при повторном п/к введении составляет 30 ± 11 ч, при повторном в/м введении – 27 ± 9 ч. Выводится преимущественно почками.
Кривые зависимости концентрации ЛГ от времени указывают на увеличение концентрации ЛГ после введения препарата Менопур, однако для фармакокинетического анализа полученных данных недостаточно.
Почечная недостаточность
Изучение фармакокинетических свойств препарата Менопур у пациентов с почечной недостаточностью не проводилось.
Печеночная недостаточность
Изучение фармакокинетических свойств препарата Менопур у пациентов с печеночной недостаточностью не проводилось.
5.3. Данные доклинической безопасности
В доклинических данных, полученных по результатам стандартных исследований, особый вред для человека не выявлен. Исследования репродуктивной токсичности препарата Менопур не проводились, поскольку препарат не показан к применению при беременности или в послеродовом периоде. Препарат Менопур содержит гормоны, секретируемые в организме человека, поэтому не обладает генотоксичностью. Исследования канцерогенности не проводились, поскольку препарат Менопур предназначен для краткосрочной терапии.
6.1. Перечень вспомогательных веществ
Лиофилизат:
Лактозы моногидрат.
Полисорбат-20.
Натрия гидроксид.
Хлористоводородная кислота.
Растворитель (0,9 % раствор натрия хлорида):
Натрия хлорид.
Хлористоводородная кислота разведенная 10 %.
Вода для инъекций.
6.2. Несовместимость
Препарат не следует смешивать в одном шприце с другими лекарственными средствами!
6.3. Срок годности (срок хранения)
Лиофилизат: 2 года.
Растворитель: 3 года.
6.4. Особые меры предосторожности при хранении
При температуре не выше 25 °С. Не замораживать. Хранить в оригинальной упаковке для защиты от света.
6.5. Характер и содержание первичной упаковки
Флакон с лиофилизатом: по 75 МЕ ФСГ + 75 МЕ ЛГ во флакон бесцветного стекла типа I, укупоренный резиновой пробкой с алюминиевой обкаткой и крышкой типа «флип-офф».
Ампула с растворителем: по 1 мл раствора в ампулы бесцветного стекла типа I с возможным цветным кодированием в виде цветной точки и/или одного или нескольких колец.
По 5 флаконов с лиофилизатом и 5 ампул с растворителем в контурную ячейковую упаковку. Одна или две ячейковые упаковки с инструкцией по применению в картонной пачке.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Рекомендации по приготовлению раствора
Раствор для инъекции должен быть приготовлен непосредственно перед введением с использованием прилагаемого растворителя. Не рекомендуется растворять в 1 мл прилагаемого растворителя более 3 флаконов с лиофилизатом.
Общие указания
Следует избегать встряхивания. В случае помутнения или наличия частиц в растворе его использовать нельзя!
Нет особых требований к утилизации.
Германия
Ферринг ГмбХ
Витланд 11, 24109 Киль.
Тел.: +49 431 5852 0
Факс.: +49 431 5852 35
Электронная почта: production@ferring.com.
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб, д. 52, стр. 4.
Тел.: + 7 (495) 287–0343.
Факс: + 7 (495) 287–0342.
Электронная почта: SafetyMailboxRussia@ferring.com.
Дата первой регистрации:
Общая характеристика лекарственного препарата Менопур доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» http://eec.eaeunion.org/.
МЕНОПУР® Мультидоза (менотропины)
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Менопур Мультидоза, 600 МЕ ФСГ + 600 МЕ ЛГ, лиофилизат для приготовления раствора для подкожного введения
Менопур Мультидоза, 1200 МЕ ФСГ + 1200 МЕ ЛГ, лиофилизат для приготовления раствора для подкожного введения
Действующее вещество: менотропины*.
Каждый флакон содержит менотропины (человеческий менопаузальный гонадотропин высокоочищенный, чМГ) – 600 МЕ фолликулостимулирующего гормона (ФСГ) + 600 МЕ лютеинизирующего гормона (ЛГ).
Каждый флакон содержит менотропины (человеческий менопаузальный гонадотропин высокоочищенный, чМГ) – 1200 МЕ ФСГ + 1200 МЕ ЛГ.
* Получено из мочи женщин в период постменопаузы.
Полный перечень вспомогательных веществ указан в разделе 6.1.
Лиофилизат для приготовления раствора для подкожного введения.
Лиофилизат: белая или почти белая аморфная масса.
Растворитель: бесцветный прозрачный раствор.
4.1. Показания к применению
Препарат Менопур Мультидоза показан для лечения взрослых пациентов.
У женщин:
У мужчин:
4.2. Режим дозирования и способ применения
Лечение препаратом Менопур Мультидоза следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия.
Режим дозирования
Установлено, что яичники неодинаково реагируют на введение гонадотропинов. По этой причине невозможно разработать универсальную схему дозирования. Доза должна подбираться индивидуально в зависимости от реакции яичников. Препарат Менопур Мультидоза применяют в виде монотерапии или в комбинации с агонистами или антагонистами гонадотропин-рилизинг-гормона (ГнРГ). Рекомендуемые дозы и продолжительность терапии зависят от применяемой схемы лечения.
У женщин
Ановуляция (включая СПКЯ)
Целью лечения препаратом Менопур Мультидоза является развитие одного зрелого фолликула, из которого происходит высвобождение ооцита после введения препаратов чХГ.
Лечение обычно начинают в первые 7 дней менструального цикла. Рекомендуемая начальная доза препарата Менопур Мультидоза составляет 75–150 МЕ в сутки в течение не менее 7 дней. Дальнейшую схему лечения подбирают после мониторинга ответа яичников на проводимую терапию на основании результатов ультразвукового исследования (УЗИ) или комбинации результатов УЗИ с определением концентрации эстрадиола в плазме крови. При отсутствии реакции яичников доза увеличивается на 37,5 МЕ (одно введение) не чаще 1 раза в неделю, каждое последующее повышение не должно превышать 75 МЕ. Максимальная суточная доза не должна превышать 225 МЕ. Если терапевтический ответ не достигнут в течение 4 недель, следует прекратить лечение и начать новый цикл с более высоких начальных доз.
При достижении адекватного ответа яичников на следующий день после последней инъекции препарата Менопур Мультидоза однократно вводят 5000–10000 МЕ чХГ для индукции овуляции. Пациентке рекомендуется иметь половые контакты в день введения чХГ и на следующий день введения. В качестве альтернативного метода возможно проведение внутриматочной инсеминации. Пациентка должна находиться под постоянным наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции яичников на введение препарата Менопур Мультидоза, курс терапии необходимо прекратить и отказаться от введения чХГ. Пациентке рекомендуется использовать барьерные методы контрацепции или воздержание от половых контактов до наступления менструации.
Контролируемая гиперстимуляция яичников с целью индукции роста множественных фолликулов при проведении ВРТ
Согласно протоколу применения агонистов ГнРГ в соответствии с принципом обратной связи лечение препаратом Менопур Мультидоза следует назначать примерно через 2 недели после начала лечения агонистами ГнРГ. В цикле с антагонистами ГнРГ введение препарата Менопур Мультидоза следует начинать на 2 или 3 день менструального цикла. Рекомендуемая начальная суточная доза препарата Менопур Мультидоза составляет 150–225 МЕ в течение не менее первых 5 дней лечения. Дальнейшую схему лечения подбирают после мониторинга ответа яичников на проводимую терапию на основании результатов УЗИ или комбинации результатов УЗИ с определением концентрации эстрадиола в плазме крови. Рекомендуемая повышающая доза не должна превышать 150 МЕ. Максимальная суточная доза препарата Менопур Мультидоза не должна превышать 450 МЕ. Общая продолжительность терапии не должна превышать 20 дней.
При достижении оптимальной реакции яичников после последней инъекции препарата Менопур Мультидоза назначается одна инъекция чХГ в дозе 10000 МЕ для индукции окончательного созревания фолликулов и индукции высвобождения ооцита. Пациентка должна находиться под постоянным наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции яичников на введение препарата Менопур Мультидоза курс терапии необходимо прекратить и отказаться от введения чХГ. Пациентке рекомендуется использовать барьерные методы контрацепции или воздержание от половых контактов до наступления менструации.
У мужчин
У мужчин для стимуляции сперматогенеза при гипогонадотропном гипогонадизме препарат Менопур Мультидоза рекомендуется применять в дозе от 75 МЕ до 150 МЕ 3 раза в неделю вместе с инъекциями чХГ в дозе 1500 МЕ 3 раза в неделю, если предшествующая терапия препаратами чХГ (введение 1500–5000 МЕ чХГ 3 раза в неделю) на протяжении 4–6 месяцев привела к нормализации концентрации тестостерона в плазме крови. Лечение по этой схеме следует продолжать не менее 4 месяцев до улучшения сперматогенеза. При отсутствии положительного эффекта в течение этого времени комбинированная терапия может быть продолжена до получения положительного результата терапии. Согласно исследованиям, для улучшения сперматогенеза может понадобиться не менее 18 месяцев лечения.
Особые группы пациентов
У пациентов с почечной и/или печеночной недостаточностью
Клинические исследования у пациентов с почечной и/или печеночной недостаточностью не проводились.
Дети
Показания к применению препарата Менопур Мультидоза у детей и подростков в возрасте до 18 лет отсутствуют.
Способ применения
Препарат Менопур Мультидоза вводится подкожно (п/к) после растворения лиофилизата во входящем в комплект растворителе.
Инструкция по приготовлению и введению раствора приведены в разделе 6.6.
4.3. Противопоказания
У женщин:
У мужчин:
При наличии в анамнезе заболеваний щитовидной железы и надпочечников, гиперпролактинемии, опухолей гипоталамо-гипофизарной области, соответствующее лечение должно быть проведено до начала терапии чМГ.
4.4. Особые указания и меры предосторожности при применении
С осторожностью
У женщин – наличие факторов риска развития тромбоэмболических осложнений (индивидуальная или семейная предрасположенность, ожирение с индексом массы тела (ИМТ) > 30 кг/м2), тромбофилия); заболевания маточных труб в анамнезе.
Препарат Менопур Мультидоза обладает выраженной гонадотропной активностью, в связи с чем при применении препарата могут развиваться нежелательные реакции (НР) разной степени тяжести. Лечение должно проводиться под наблюдением врача, имеющего опыт диагностики и лечения бесплодия!
Применение гонадотропинов требует присутствия квалифицированного медицинского персонала, а также соответствующего оборудования. Перед назначением препарата Менопур Мультидоза и в процессе лечения следует контролировать состояние яичников (УЗИ и концентрация эстрадиола в плазме крови). Необходимо применять препарат в наиболее низкой эффективной дозе, отвечающей целям лечения.
Первая инъекция препарата должна выполняться под непосредственным наблюдением врача.
Женщины
Перед началом применения препарата Менопур Мультидоза рекомендуется проведение диагностики причин бесплодия как у женщины, так и у ее партнера, а также установить возможные противопоказания к беременности. Перед началом лечения необходимо провести обследование женщин на наличие гипотиреоза, недостаточности надпочечников, гиперпролактинемии, опухоли гипоталамо-гипофизарной области и при необходимости провести соответствующее лечение.
Проведение контролируемой стимуляции роста фолликулов, вне зависимости от показания к применению у женщин, может привести к увеличению яичников с развитием их гиперстимуляции.
При соблюдении режима дозирования и способа введения препарата в сочетании с мониторингом проводимой терапии, возможно минимизировать риск возникновения вышеуказанных реакций.
Оценка развития фолликула должна проводиться врачом, имеющим соответствующий опыт.
Синдром гиперстимуляции яичников
Синдром гиперстимуляции яичников (СГЯ) – синдром, отличный от неосложненного увеличения яичников, проявления которого зависят от степени тяжести. Он включает в себя значительное увеличение яичников, высокую концентрацию эстрогенов в плазме крови, а также увеличение проницаемости сосудов, что может привести к накоплению жидкости в брюшной, плевральной и, реже, перикардиальной полости.
В тяжелых случаях СГЯ возможны следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и симптомы со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При клиническом обследовании возможно выявление гиповолемии, гемоконцентрации, электролитных нарушений, асцита, гемоперитонеума, экссудативного плеврита, гидроторакса, острого респираторного дистресс-синдрома и тромбоэмболических осложнений.
Чрезмерная реакция яичников на введение гонадотропинов редко приводит к развитию СГЯ, если не вводится чХГ с целью стимуляции овуляции. Поэтому в случае гиперстимуляции яичников не следует вводить чХГ, а пациентку следует предупредить о необходимости воздерживаться от половых контактов или использовать барьерные методы контрацепции не менее 4 дней. СГЯ может быстро прогрессировать (в течение от 24 ч до нескольких дней), становясь серьезным ятрогенным осложнением, поэтому необходимо тщательное наблюдение за пациентками, по крайней мере, в течение не менее 2-х недель после введения чХГ.
Соблюдение рекомендованных доз препарата Менопур Мультидоза, режима введения и тщательный контроль терапии может свести к минимуму случаи гиперстимуляции яичников и многоплодной беременности. При проведении ВРТ аспирация содержимого всех фолликулов до наступления овуляции может снизить риск развития СГЯ.
СГЯ может быть более тяжелым и затяжным при развитии беременности. Чаще всего СГЯ развивается после прекращения лечения гонадотропинами и достигает максимума тяжести через 7–10 дней после окончания лечения. Обычно СГЯ проходит спонтанно после начала менструации.
При развитии СГЯ тяжелой степени лечение прекращают, пациентку госпитализируют и начинают специфическую терапию.
Развитие СГЯ более характерно для пациенток с СПКЯ.
Многоплодная беременность
При многоплодной беременности отмечается повышенный риск неблагоприятных материнских и перинатальных исходов.
При применении менотропинов многоплодная беременность развивается чаще, чем при естественном зачатии. Отмечается наиболее высокая частота рождения двойни. Для уменьшения риска многоплодной беременности рекомендуется тщательный мониторинг ответа яичников на стимуляцию.
В случае проведения ВРТ вероятность возникновения многоплодной беременности зависит от числа введенных эмбрионов, их качества и возраста пациентки.
Пациентка должна быть предупреждена о потенциальном риске многоплодной беременности до начала лечения бесплодия.
Осложнения беременности
Частота самопроизвольных абортов и преждевременных родов при беременности, наступившей после лечения препаратом Менопур Мультидоза, выше, чем у здоровой женщины.
Эктопическая беременность
У пациенток с заболеваниями маточных труб в анамнезе, как при естественном зачатии, так и при лечении бесплодия, имеется высокий риск возникновения эктопической беременности. Распространенность внематочной беременности после ЭКО составляет от 2 до 5% по сравнению с 1 до 1,5% в общей популяции.
Новообразования органов репродуктивной системы
Имеются сообщения о новообразованиях яичников и других органов репродуктивной системы, как доброкачественных, так и злокачественных, у женщин, неоднократно получавших препараты для лечения бесплодия. В настоящее время не установлено, увеличивает ли лечение гонадотропинами исходный риск этих опухолей у женщин с бесплодием.
Врожденные пороки развития
Распространенность врожденных пороков развития плода при использовании ВРТ несколько выше, чем при естественном зачатии. Считается, что это может быть связано с индивидуальными особенностями родителей (возрастом матери, характеристиками спермы) и многоплодной беременностью.
Тромбоэмболические осложнения
Женщины с известными факторами риска развития тромбоэмболических осложнений, таких как индивидуальная или семейная предрасположенность, ожирение (ИМТ > 30 кг/м2) или тромбофилия, могут иметь повышенный риск венозных или артериальных тромбоэмболических осложнений во время или после лечения гонадотропинами. В таких случаях польза их применения должна быть сопоставлена с возможным риском. Следует учитывать, что сама беременность также повышает риск развития тромбоэмболических осложнений.
Мужчины
Применение препарата Менопур Мультидоза у мужчин с высокой концентрацией ФСГ неэффективно. Для оценки эффективности лечения проводят анализ спермы через 4–6 месяцев после начала лечения.
Вспомогательные вещества
Препарат Менопур Мультидоза содержит менее 1 ммоль (23 мг) натрия на дозу, то есть по сути не содержит натрия.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Исследование лекарственных взаимодействий препарата Менопур Мультидоза не проводилось.
Одновременное применение менотропинов с кломифеном может усилить стимуляцию роста фолликулов, несмотря на отсутствие клинических данных о совместном применении этих препаратов. Совместное применение с агонистами ГнРГ может потребовать увеличения дозы менотропинов для достижения оптимальной реакции яичников.
4.6. Фертильность, беременность и лактация
Применение препарата Менопур Мультидоза противопоказано во время беременности и в период грудного вскармливания.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Исследования влияния менотропинов на способность управлять транспортными средствами и механизмами не проводились. Маловероятно, что препарат Менопур Мультидоза оказывает отрицательное воздействие на способность управлять транспортными средствами и другими механизмами.
4.8. Нежелательные реакции
Резюме профиля безопасности
Наиболее серьезными и частыми НР, выявленными при применении препарата Менопур Мультидоза в клинических исследованиях с частотой до 5%, были СГЯ, боль в животе, головная боль, вздутие живота и боль в месте инъекции.
Табличное резюме нежелательных реакций
Частота НР: часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), редко (≥ 1/10000 до <1/1000), частота неизвестна (в настоящее время данные о распространенности НР отсутствуют, зарегистрированы в период пострегистрационного применения препарата).
Основные НР, выявленные в клинических исследованиях и в ходе пострегистрационного применения, приведены ниже в таблице.
|
Системно-органный класс |
Часто (≥1/100, <1/10) |
Нечасто (≥1/1000, <1/100) |
Редко (≥1/10000, <1/1000) |
Частота неизвестна |
|
Нарушения со стороны иммунной системы |
|
|
|
Реакции гиперчувствительности* |
|
Нарушения со стороны нервной системы |
Головная боль |
Головокружение |
|
|
|
Нарушения со стороны органа зрения |
|
|
|
Преходящая слепота, диплопия, мидриаз, скотома, фотопсия, преходящее помутнение стекловидного тела, снижение четкости зрения |
|
Нарушения со стороны сосудов |
|
«Приливы» жара |
|
Венозные и артериальные тромбоэмболии (как правило, при СГЯ) |
|
Желудочно-кишечные нарушения |
Боль в животе, вздутие живота, тошнота |
Рвота, дискомфорт в животе, диарея |
|
|
|
Нарушения со стороны кожи и подкожных тканей |
|
|
Угревая сыпь, кожные высыпания |
Кожный зуд, крапивница |
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
|
|
|
Боль в суставах, боль в спине и шее, боль в конечностях |
|
Нарушения со стороны репродуктивной системы и молочных желез |
СГЯ**, тазовая боль*** |
Кисты яичников, нарушения со стороны молочных желез**** |
|
Перекрут яичника** |
|
Общие нарушения и реакции в месте введения |
Боль в месте инъекции |
Повышенная утомляемость |
|
Повышение температуры тела, недомогание |
|
Лабораторные и инструментальные данные |
|
|
|
Увеличение массы тела |
* Отмечались редкие случаи местных или общих аллергических реакций, в т.ч. случаи анафилактических реакций.
** В клинических исследованиях отмечались связанные с развитием СГЯ нарушения со стороны желудочно-кишечного тракта, такие как вздутие и дискомфорт в животе, тошнота, рвота и диарея. В случаях тяжелого СГЯ в качестве редких осложнений возможно развитие асцита и скопление жидкости в полости таза, экссудативного плеврита, одышки, олигурии, тромбоэмболических осложнений и перекрута яичника.
*** Боль в области придатков матки.
**** Боль и дискомфорт в молочных железах, нагрубание и отечность молочных желез, боль в сосках.
При применении менотропинов у мужчин были отмечены случаи гинекомастии, акне и увеличения массы тела.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
|
Российская Федерация Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1 Федеральная служба по надзору в сфере здравоохранения Российской Федерации Телефон: +7 (495) 698–45–38, +7 (499) 578–02–20 Электронная почта: pharm@roszdravnadzor.gov.ru |
4.9. Передозировка
Случаи передозировки при применении препарата Менопур Мультидоза неизвестны, однако в таких ситуациях следует ожидать развитие СГЯ (см. раздел 4.4).
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: гонадотропины и другие стимуляторы овуляции.
Код АТХ: G03GA02.
Механизм действия, фармакодинамические эффекты
Действующим веществом препарата Менопур Мультидоза является чМГ высокой степени очистки, получаемый из мочи женщин в период постменопаузы. Препарат содержит ФСГ и лютеинизирующий гормон ЛГ.
Органами-мишенями для гормонального эффекта чМГ у женщин являются яичники. чМГ стимулирует гаметогенез и синтез половых гормонов.
ФСГ является ключевым фактором роста и развития фолликулов на стадии раннего фолликулогенеза. ЛГ играет важную роль в продукции половых гормонов яичниками и вовлечен в физиологические процессы, приводящие к развитию полноценного преовуляторного фолликула. Стимуляция фолликулярного роста под действием ФСГ, в случае полного отсутствия ЛГ, завершается патологическим развитием фолликула, ассоциированным с низкой концентрацией эстрадиола и неспособностью к лютеинизации неовулирующего фолликула в ответ на нормальный овуляторный стимул.
Принимая во внимание действие ЛГ, заключающееся в усилении синтеза половых гормонов, применение препарата Менопур Мультидоза в циклах ЭКО/ИКСИ связана с более высокой концентрацией эстрадиола в плазме крови, чем при применении препаратов рекомбинантного ФСГ. Данный аспект следует учитывать при контроле ответа на применение препарата по динамике изменения концентрации эстрадиола. Различия в концентрации эстрадиола в протоколах при применении низких доз препарата для индукции овуляции у пациенток с ановуляторным циклом не обнаружены.
Органами-мишенями для гормонального эффекта чМГ у мужчин являются яички. В яичках ФСГ индуцирует созревание клеток Сертоли, что преимущественно оказывает влияние на деление клеток извитых канальцев и развитие сперматозоидов. При этом необходима высокая внутритестикулярная концентрация андрогенов, которая достигается предшествующей терапией чХГ.
5.2. Фармакокинетические свойства
Был установлен фармакокинетический профиль ФСГ, входящего в состав препарата Менопур Мультидоза.
Абсорбция и распределение
Максимальная концентрация (Сmaх) ФСГ в плазме крови достигается в течение 7 ч после п/к введения. Объем распределения, определяемый у здоровых женщин-добровольцев со сниженным количеством рецепторов, после введения повторных доз 150 МЕ в течение 7 дней составляет 8,9 ± 3,5 МЕ/л.
Элиминация
Период полувыведения при повторном введении составляет 30 ± 11 ч. Выводится преимущественно почками.
Кривые зависимости концентрации ЛГ от времени указывают на увеличение концентрации ЛГ после введения препарата Менопур Мультидоза, однако для фармакокинетического анализа полученных данных недостаточно.
Почечная недостаточность
Изучение фармакокинетических свойств препарата Менопур Мультидоза у пациентов с почечной недостаточностью не проводилось.
Печеночная недостаточность
Изучение фармакокинетических свойств препарата Менопур Мультидоза у пациентов с печеночной недостаточностью не проводилось.
5.3. Данные доклинической безопасности
В доклинических данных, полученных по результатам стандартных исследований, особый вред для человека не выявлен. Исследования репродуктивной токсичности препарата Менопур Мультидоза не проводились, поскольку препарат не показан к применению при беременности или в послеродовом периоде. Препарат Менопур Мультидоза содержит гормоны, секретируемые в организме человека, поэтому не обладает генотоксичностью. Исследования канцерогенности не проводились, поскольку препарат Менопур Мультидоза предназначен для краткосрочной терапии.
6.1. Перечень вспомогательных веществ
Лиофилизат:
Лактозы моногидрат.
Полисорбат-20.
Натрия гидрофосфата гептагидрат.
Фосфорной кислоты раствор 1 М.
Натрия гидрофосфата раствор 0,5 М.
Растворитель:
Метакрезол.
Вода для инъекций.
6.2. Несовместимость
Не допускается смешивание препарата Менопур Мультидоза с другими лекарственными средствами в одном шприце!
6.3. Срок годности (срок хранения)
3 года.
6.4. Особые меры предосторожности при хранении
При температуре 2–8 °С. Не замораживать. Хранить в оригинальной упаковке для защиты от света. Приготовленный раствор хранить не более 28 дней при температуре не выше 25 °C.
6.5. Характер и содержание первичной упаковки
Менопур Мультидоза, 600 МЕ ФСГ+600 МЕ ЛГ, лиофилизат для приготовления раствора для подкожного введения
По 600 МЕ ФСГ + 600 МЕ ЛГ во флаконы бесцветного стекла типа I, укупоренные бромобутиловой пробкой с алюминиевой обкаткой и крышкой типа «флип-офф».
По 1 мл растворителя в шприцах для одноразового использования бесцветного стекла типа I с резиновым колпачком-наконечником.
1 флакон с лиофилизатом, 1 шприц с растворителем, 1 игла для приготовления раствора в индивидуальной упаковке, 9 шприцев для одноразового использования, градуированных от «0 МЕ» до «600 МЕ» с ценой деления «37,5 МЕ» ФСГ+ЛГ, с иглами в индивидуальных упаковках, с инструкцией по применению в картонную пачку.
Менопур Мультидоза, 1200 МЕ ФСГ+1200 МЕ ЛГ, лиофилизат для приготовления раствора для подкожного введения
По 1200 МЕ ФСГ + 1200 МЕ ЛГ во флаконы бесцветного стекла типа I, укупоренные бромобутиловой пробкой с алюминиевой обкаткой и крышкой типа «флип-офф».
По 1 мл растворителя в шприцах для одноразового использования бесцветного стекла типа I с резиновым колпачком-наконечником.
1 флакон с лиофилизатом, 2 шприца с растворителем, 1 игла для приготовления раствора в индивидуальной упаковке, 18 шприцев для одноразового использования, градуированных от «0 МЕ» до «600 МЕ» с ценой деления «37,5 МЕ» ФСГ+ЛГ, с иглами в индивидуальных упаковках, с инструкцией по применению в картонную пачку.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Инструкция по приготовлению раствора
Раствор готовят непосредственно перед введением путем растворения лиофилизата в прилагаемом растворителе. Готовый раствор может вводиться многократно, применение возможно в течение не менее 28 дней.
Снимите пластмассовую крышечку с флакона с лиофилизатом. Присоедините иглу для приготовления раствора к шприцу с растворителем и снимите защитный колпачок (Рис.1, 2).
ФЛАКОН ДЕРЖАТЬ ВЕРТИКАЛЬНО!
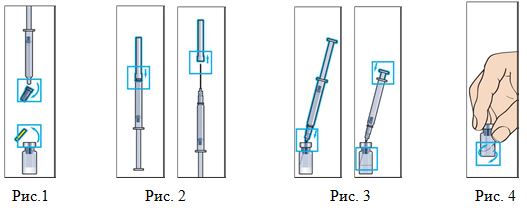
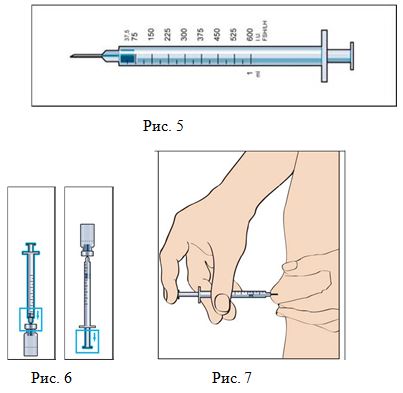
Общие указания
Следует избегать встряхивания. В случае помутнения или наличия частиц в растворе его использовать нельзя!
Нет особых требований к утилизации.
Чешская Республика
Ферринг Лечива а.с.
К Рубнику 475, 25242 Есенице у Прагу.
Тел.: +420 2 410 41 111.
Электронная почта: production@ferring.com
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб, д. 52, стр. 4.
Тел.: + 7 (495) 287–0343.
Факс: + 7 (495) 287–0342.
Электронная почта: SafetyMailboxRussia@ferring.com.
Дата первой регистрации:
Общая характеристика лекарственного препарата Менопур Мультидоза доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» http://eec.eaeunion.org/.
РЕКОВЕЛЛЬ® (фоллитропин дельта)
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Рековелль, 33,3 мкг/мл, раствор для подкожного введения.
Действующее вещество: фоллитропин дельта.
1 картридж содержит фоллитропин дельта 12,0 мкг, 36,0 мкг или 72,0 мкг. 1 мл раствора содержит 33,3 мкг фоллитропина дельта.
Полный перечень вспомогательных веществ приведен в разделе 6.1.
Раствор для подкожного введения.
Прозрачный бесцветный раствор.
4.1. Показания к применению
Контролируемая стимуляция яичников у взрослых женщин с целью индукции роста множественных фолликулов при проведении циклов программ вспомогательных репродуктивных технологий (ВРТ): экстракорпорального оплодотворения (ЭКО) или интрацитоплазматической инъекции сперматозоида в яйцеклетку (ИКСИ).
4.2. Режим дозирования и способ применения
Терапию препаратом Рековелль следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия.
Режим дозирования
Режим дозирования препарата Рековелль подбирается индивидуально для каждой пациентки с целью достижения ответа яичников с благоприятным соотношением безопасности и эффективности терапии, т.е. получения достаточного количества ооцитов и снижения частоты возникновения синдрома гиперстимуляции яичников (СГЯ). Доза препарата указывается в микрограммах. Режим дозирования и доза препарата Рековелль в микрограммах являются специфичными и не могут применяться к другим лекарственным препаратам гонадотропинов. В первом цикле терапии суточная доза препарата определяется на основании концентрации антимюллерова гормона (АМГ) в плазме крови и массы тела пациентки. При подборе дозы необходимо взять за основу последнее значение АМГ (за предшествующие 12 месяцев), определенное с помощью автоматизированного иммунотеста типа «Elecsys AMH Plus». Величина индивидуальной суточной дозы остается неизменной в течение всего периода стимуляции яичников.
У женщин с концентрацией АМГ < 15 пмоль/л независимо от массы тела суточная доза составляет 12 мкг. При концентрации АМГ ≥ 15 пмоль/л суточная доза фоллитропина дельта варьирует в диапазоне 0,10 – 0,19 мкг/кг массы тела в зависимости от концентрации АМГ (см. таблицу 1). Для соответствия рассчитанной дозировки препарата шкале на шприц-ручке, возможно округление дозы до ближайших 0,33 мкг. Максимальная суточная доза препарата в первом цикле стимуляции составляет 12 мкг.
Для определения дозы препарата Рековелль необходимо измерить массу тела пациентки (без обуви и верхней одежды) непосредственно перед началом цикла стимуляции.
Таблица 1
Режим дозирования
|
АМГ, пмоль/л |
< 15 |
15- 16 |
17 |
18 |
19- 20 |
21- 22 |
23- 24 |
25- 27 |
28- 32 |
33- 39 |
≥ 40 |
|
Фиксированная суточная доза препарата Рековелль |
12 мкг |
0,19 мкг/ кг |
0,18 мкг/ кг |
0,17 мкг/ кг |
0,16 мкг/ кг |
0,15 мкг/ кг |
0,14 мкг/ кг |
0,13 мкг/ кг |
0,12 мкг/ кг |
0,11 мкг/ кг |
0,10 мкг/ кг |
Концентрация АМГ выражается в пмоль/л и округляется до целого числа. Если значение АМГ представлено в нг/мл, необходимо перевести единицы измерения в пмоль/л путем умножения на 7,14 (нг/мл х 7,14 = пмоль/л).
Терапию препаратом Рековелль начинают на 2 или 3 день менструального цикла в протоколе с антагонистами гонадотропин-рилизинг гормона (ГнРГ) или примерно через 2 недели после начала терапии агонистами в рамках протокола с применением агонистов ГнРГ. Терапию продолжают вплоть до образования необходимого количества фолликулов (≥ 3 фолликулов диаметром ≥ 17 мм), что, как правило, соответствует 9-му дню терапии (продолжительность терапии варьирует от 5 до 20 суток). Для индукции окончательного созревания фолликулов однократно вводят 250 мкг рекомбинантного человеческого хорионического гонадотропина (ХГЧ) или 5000 МЕ ХГЧ. Если у пациентки отмечается формирование большого числа фолликулов (> 25 фолликулов диаметром ≥ 12 мм) введение препарата Рековелль необходимо прекратить, индукция окончательного созревания фолликулов не проводится.
При необходимости дополнительных циклов терапии суточная доза препарата Рековелль может оставаться неизменной или корректироваться в зависимости от ответа яичников в предыдущем цикле. Если выраженность ответа яичников в предыдущем цикле была удовлетворительной, без развития СГЯ, следует применять препарат в аналогичной суточной дозе. В случае недостаточно выраженного ответа яичников в предшествующем цикле, следует увеличить дозу препарата на 25 % или 50 %. Если в предыдущем цикле стимуляции яичников наблюдался избыточный ответ яичников, необходимо снизить дозу препарата на 20 % или 33 % в следующем цикле, в зависимости от выраженности ответа на лечение. В случае развития СГЯ в предыдущем цикле или риска возникновения СГЯ необходимо уменьшить суточную дозу на 33 % в последующем цикле. Максимальная суточная доза препарата 24 мкг.
Особые группы пациенток
Нарушение функции почек и печени
В клинических исследованиях препарата Рековелль не проводилась оценка фармакокинетики, эффективности и безопасности применения препарата у пациенток с почечной и печеночной недостаточностью. Несмотря на ограниченные клинические данные, необходимость коррекции дозы фоллитропина дельта в данных популяциях пациенток отсутствует.
Ановуляция, связанная с синдромом поликистозных яичников
Применение препарата Рековелль не исследовалось у пациенток с ановуляцией, связанной с синдромом поликистозных яичников (СПКЯ). Клинические исследования препарата проводились у женщин с СПКЯ с сохранной овуляцией.
Пациентки пожилого возраста
Препарат не применяется у пациенток пожилого возраста в связи с отсутствием показаний.
Пациентки с концентрацией АМГ > 35 пмоль/л
Пациентки с концентрацией АМГ > 35 пмоль/л не исследовались в рамках протокола с применением агонистов ГнРГ.
Дети
Показания к применению препарата у детей и подростков в возрасте до 18 лет отсутствуют.
Способ применения
Препарат Рековелль предназначен для подкожного введения (п/к), предпочтительно в область передней брюшной стенки. Первую инъекцию препарата следует проводить под непосредственным наблюдением медицинского работника. Ежедневные однократные инъекции препарата рекомендуется проводить в одно и то же время, каждый раз меняя место инъекции.
Пациентки должны быть обучены использованию шприц-ручки и методике проведения инъекции препарата Рековелль.
Самостоятельное введение препарата допускается только в том случае, если пациентка хорошо мотивирована, обучена методике проведения инъекции и имеет возможность в случае необходимости проконсультироваться с врачом (рекомендации по самостоятельному введению препарата с помощью предварительно заполненной шприц-ручки представлены в приложении к листку-вкладышу).
4.3. Противопоказания
4.4. Особые указания и меры предосторожности при применении
Прослеживаемость
Для улучшения прослеживаемости применения биологических лекарственных препаратов в медицинской документации пациента следует указывать торговое наименование препарата и номер серии.
Фоллитропин дельта обладает выраженным гонадотропным действием, в связи с чем, на фоне терапии возможно развитие нежелательных реакций различной степени тяжести. Терапия препаратом Рековелль должна проводиться только врачом, имеющим опыт диагностики и лечения бесплодия!
Применение гонадотропинов требует присутствия квалифицированного медицинского персонала, а также соответствующего оборудования. Безопасное и эффективное применение фоллитропина дельта требует проведение регулярного контроля ответа яичников на терапию путем проведения ультразвукового исследования (УЗИ), как отдельно, так и в комбинации с динамической оценкой концентрации эстрадиола в плазме крови. Для достижения ответа яичников с благоприятным соотношением безопасности и эффективности доза препарата Рековелль для каждой пациентки подбирается индивидуально. Выраженность ответа на введение фоллитропина дельта у разных пациенток может иметь существенные отличия: с крайне низким ответом на терапию у одних и избыточным ответом у других пациенток.
Перед началом терапии следует провести необходимую диагностику причин бесплодия как у женщины, так и у ее партнера, а также установить возможные противопоказания к беременности. Перед началом лечения необходимо провести обследование женщины на наличие заболеваний щитовидной железы и надпочечников, гиперпролактинемии, опухолей гипоталамо-гипофизарной области и при необходимости провести соответствующее лечение. При определении дозы препарата Рековелль не рекомендуется использовать результаты определения концентрации АМГ, полученные иммунотестом, отличным от автоматизированного теста типа «Elecsys AMH Plus».
При проведении процедуры контролируемой стимуляции роста фолликулов у пациенток может отмечаться увеличение размеров яичников с появлением риска развития СГЯ. Тщательное соблюдение режима дозирования препарата Рековелль, а также тщательный контроль проведения терапии позволяют минимизировать риск развития этой нежелательной реакции.
Синдром гиперстимуляции яичников
Некоторое увеличение размеров яичников является ожидаемым эффектом их контролируемой стимуляции и чаще развивается у пациенток с СПКЯ, обычно регрессирует самостоятельно, без дополнительной терапии.
В отличие от неосложненного увеличения яичников, клинические симптомы СГЯ могут проявляться с нарастающей выраженностью. Они включают в себя: значительное увеличение яичников, высокую концентрацию эстрогенов в плазме крови, а также увеличение проницаемости сосудов, что может привести к накоплению жидкости в брюшной, плевральной и, реже, перикардиальной полости.
Для снижения риска развития СГЯ необходимо проводить тщательный и частый мониторинг созревания фолликулов. В тяжелых случаях СГЯ возможны следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и нарушения со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При клиническом обследовании возможно выявление гиповолемии, гемоконцентрации, электролитных нарушений, асцита, гемоперитонеума, экссудативного плеврита, гидроторакса, острого респираторного дистресс-синдрома. Очень редко СГЯ тяжелой степени может осложняться перекрутом яичника или тромбоэмболическими осложнениями, такими как тромбоэмболия легочной артерии, ишемический инсульт или инфаркт миокарда.
В отсутствии введения ХГЧ, необходимого для заключительного созревания фолликулов, избыточный ответ яичников на терапию гонадотропинами редко становится причиной развития СГЯ. Более того, в случае возникновения беременности СГЯ может быть более затяжным и тяжелым. Соответственно, в случае выявления гиперстимуляции яичников не следует вводить ХГЧ, а также необходимо рекомендовать пациенткам воздержание от половых контактов или использование барьерных методов контрацепции в течение не менее 4 суток. СГЯ может быстро прогрессировать (в течение от 24 часов до нескольких суток) и стать причиной тяжелого состояния пациентки. Ранний СГЯ может развиваться в течение 9 дней после индукции окончательного созревания фолликулов. Поздний СГЯ может наступить через 10 и более дней после введения триггера окончательного созревания фолликулов как следствие гормональных изменений наступившей беременности. Риск развития СГЯ требует тщательного динамического наблюдения за состоянием женщины в течение не менее 2-х недель после введения ХГЧ.
Тромбоэмболические осложнения
У женщин, имеющих в анамнезе или в настоящее время тромбоэмболические осложнения, а также у женщин с известными факторами риска таких осложнений, такие как индивидуальная или семейная предрасположенность, ожирение (индекс массы тела [ИМТ] > 30 кг/м2) или тромбофилия, отмечается повышенный риск развития венозных или артериальных тромбоэмболических осложнений как во время применения гонадотропинов, так и непосредственно после его завершения. Терапия гонадотропинами может способствовать дополнительному увеличению риска возникновения или нарастания тяжести таких осложнений. В таких случаях польза их применения должна быть сопоставлена с возможным риском. Следует учитывать, что сама беременность также повышает риск развития тромбоэмболических осложнений.
Перекрут яичника
При проведении ВРТ описаны случаи развития перекрута яичника (перекручивания сосудистой ножки яичника). Причиной перекрута яичника могут быть СГЯ, беременность, проведенные ранее хирургические вмешательства на брюшной полости, перекрут яичника в анамнезе, наличие кисты яичника в настоящее время или в анамнезе, а также СПКЯ. Повреждения яичника вследствие нарушения притока крови могут быть уменьшены при своевременной диагностике и проведении экстренной деторсии яичника.
Многоплодная беременность
При многоплодной беременности отмечается повышенный риск неблагоприятных материнских и перинатальных исходов.
В случае проведения ВРТ вероятность возникновения многоплодной беременности зависит от количества переносимых эмбрионов, их качества и возраста пациентки. В редких случаях отмечались случаи беременности двойней даже при переносе одного эмбриона.
Пациентка должна быть предупреждена о потенциальном риске многоплодной беременности до начала лечения.
Прерывание беременности
У пациенток, которым проводится контролируемая стимуляция яичников в рамках программ ВРТ, частота внутриутробной гибели плода и прерывания беременности (самопроизвольного аборта, выкидыша) выше, чем при естественном зачатии.
Эктопическая беременность
У пациенток с заболеваниями маточных труб в анамнезе, как при естественном зачатии, так и при лечении бесплодия, имеется высокий риск возникновения эктопической беременности. Распространенность внематочной беременности после ВРТ выше по сравнению с общей популяцией.
Новообразования органов репродуктивной системы
Имеются сообщения о новообразованиях яичников и других органов репродуктивной системы, как доброкачественных, так и злокачественных, у женщин после проведения нескольких курсов лечения бесплодия. В настоящее время не установлено, увеличивает ли лечение гонадотропинами исходный риск этих опухолей у женщин с бесплодием.
Врожденные пороки развития
Распространенность врожденных пороков развития плода при использовании ВРТ несколько выше, чем при естественном зачатии. Считается, что это может быть связано с индивидуальными особенностями родителей (возрастом матери, характеристиками спермы) и многоплодной беременностью.
Нарушение функции печени и почек
Применение фоллитропина дельта у пациенток с почечной недостаточностью средней степени тяжести и тяжелой степени или печеночной недостаточностью не изучалось.
Содержание натрия
Препарат Рековелль практически не содержит натрий (менее 1 ммоль натрия (23 мг) на дозу).
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Исследований взаимодействия фоллитропина дельта с другими лекарственными средствами не проводилось. При гипофизарной десенситизации, вызванной агонистом ГнРГ, для достижения адекватного фолликулярного ответа может потребоваться более длительная стимуляция и, следовательно, более высокая общая доза препарата Рековелль. В пострегистрационном периоде применения препарата Рековелль не сообщалось о каких-либо клинически значимых взаимодействиях фоллитропина дельта с другими лекарственными средствами.
4.6. Фертильность, беременность и лактация
Беременность
Применение препарата Рековелль во время беременности противопоказано. При применении в клинической практике для контролируемой гиперстимуляции яичников тератогенного действия гонадотропинов не выявлено. Данные о случайном применении препарата Рековелль отсутствуют. В исследованиях на животных было показано, что фоллитропин дельта обладает репродуктивной токсичностью при применении в дозах, превышающих максимальную терапевтическую дозу для человека.
Лактация
Применение препарата Рековелль в период грудного вскармливания противопоказано.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Применение препарата Рековелль не оказывает или оказывает незначительное влияние на способность к управлению транспортными средствами и механизмами.
4.8. Нежелательные реакции
Резюме нежелательных реакций
Наиболее частыми нежелательными реакциями (НР) при применении препарата Рековелль были: СГЯ, головная боль, боль в области таза, тошнота и повышенная утомляемость. При проведении клинических исследований было отмечено, что при повторных циклах стимуляции яичников частота развития НР снижается.
В таблице ниже указаны НР, отмеченные в ходе проведения клинических исследований у пациентов, проходивших терапию препаратом Рековелль с использованием режима дозирования на основе алгоритма. В каждой группе НР представлены в порядке убывания их тяжести.
|
Системно-органный класс |
Часто (≥ 1/100 и < 1/10) |
Нечасто (≥ 1/1000 и <1/100) |
|
Психические нарушения |
|
Перепады настроения |
|
Нарушения со стороны нервной системы |
Головная боль |
Сонливость, головокружение |
|
Желудочно-кишечные нарушения |
Тошнота |
Диарея, рвота, запор, дискомфорт в животе1 |
|
Нарушения со стороны репродуктивной системы и молочных желез |
СГЯ2, боль в области таза3 |
Влагалищное кровотечение, жалобы со стороны молочных желез4 |
|
Общие нарушения и реакции в месте введения |
Повышенная утомляемость |
- |
1 – дискомфорт в животе включает боль в животе/вздутие
2 – СГЯ представляет собой неотъемлемый риск стимуляции яичников. Известные желудочно- кишечные симптомы, связанные с СГЯ, включают боль в животе, дискомфорт и вздутие живота, тошноту, рвоту и диарею. Установлено, что перекрут яичника и тромбоэмболические осложнения являются редкими осложнениями стимуляции яичников (см. раздел 4.4)
3 – боль в области таза включает дискомфорт в области таза и боль в области придатков матки
4 – жалобы со стороны молочных желез включают боль в молочных железах, отек молочных желез, набухание молочных желез, дискомфорт в области молочных желез и/или боль в области сосков
Описание отдельных нежелательных реакций
При применении гонадотропинов имеется риск развития иммуногенности с образованием антител к ФСГ.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
|
Российская Федерация Федеральная служба по надзору в сфере здравоохранения Российской Федерации Адрес: 109012, г. Москва, Славянская площадь, д. 4, стр. 1 Телефон: +7 (800) 550–90–03 Электронная почта: pharm@roszdravnadzor.gov.ru Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.roszdravnadzor.gov.ru/ |
|
Республика Казахстан РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Адрес: 010000, г. Астана, район Байконыр, ул. Амангелді Иманова, д. 13 Телефон: +7 (7172) 235–135 Электронная почта: pdlc@dari.kz Сайт в информационно-телекоммуникационной сети «Интернет»: http://www.ndda.kz/ |
4.9. Передозировка
Случаи передозировки при приеме препарата Рековелль неизвестны, однако в таких ситуациях возможно развитие СГЯ.
Подробнее см. раздел 4.4.
5. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: фолликулостимулирующее средство.
Код АТХ: G03GA10.
Механизм действия, фармакодинамические эффекты
К наиболее важному действию парентерального введения ФСГ относится формирование множественных зрелых фолликулов.
Фоллитропин дельта – рекомбинантный фолликулостимулирующий гормон человека (рчФСГ), является препаратом, стимулирующим рост и развитие фолликулов. При подкожном введении (п/к) рчФСГ наблюдается образование множественных зрелых фолликулов. Аминокислотная последовательность двух субъединиц фоллитропина дельта идентична последовательности аминокислот в эндогенном рчФСГ человека. Синтез фоллитропина дельта осуществляется с использованием клеток человека линии PER.C6, его профиль гликозилирования отличен от фоллитропина альфа и фоллитропина бета.
При проведении теста Steelman-Pohley у крыс in vivo при ежедневном введении фоллитропина дельта и фоллитропина альфа, используемых в эквивалентных дозах, выраженных в единицах действия (МЕ), более выраженный ответ яичников наблюдался у особей, получавших фоллитропин дельта (ответ яичников оценивался по концентрации эстрадиола, ингибина В и размеру фолликулов). Поскольку данный тест не позволяет дать полную оценку биологической активности препарата, дозировка фоллитропина дельта приводится в микрограммах, а не в единицах действия (МЕ). Согласно данным клинических исследований применение препарата Рековелль в суточной дозе 10,0 мкг (95% доверительный интервал [9,2; 10,8]) обеспечивает у большинства пациентов ответ яичников, близкий к ответу при применении фоллитропина альфа в дозе 150 МЕ/день.
При увеличении дозы фоллитропина дельта и концентрации антимюллерова гормона (АМГ) в плазме крови число созревших фолликулов увеличивается. Наоборот, при большой массе тела число созревших фолликулов уменьшается (имеет клиническое значение только при применении фоллитропина дельта в дозировке ниже 12 мкг).
Клиническая эффективность и безопасность
Рандомизированное, контролируемое, слепое для лиц, проводящих оценку, исследование ESTHER-1 проведено при участии 1326 пациенток из циклов ЭКО/ИКСИ. В рамках исследования было проведено сравнение индивидуально подобранного для каждой пациентки режима дозирования препарата Рековелль, который остается неизменным на протяжении цикла стимуляции (см. раздел 4.2.), с терапией фоллитропином альфа, начальная доза которого составляет 11 мкг (150 МЕ) в течение первых 5 дней лечения с последующей коррекцией дозы, начиная с 6 дня стимуляции, в зависимости от интенсивности образования фолликулов в рамках протокола с применением антагониста ГнРГ. В исследование включались женщины в возрасте до 40 лет с регулярным менструальным циклом, который был сочтен овуляторным. На 5 сутки после извлечения яйцеклеток всем женщинам осуществлялся перенос одного эмбриона, за исключением женщин в возрасте 38-40 лет, у которых допускался перенос двух эмбрионов в случае, если пригодные для переноса эмбрионы хорошего качества отсутствовали. Двумя основными равнозначными критериями оценки результатов исследования являлись частота наступления развивающейся беременности и частота успешной имплантации в цикле переноса «свежих» эмбрионов, определяемые, соответственно, как, по крайней мере один жизнеспособный плод в полости матки через 10-11 недель после переноса эмбриона и отношение числа жизнеспособных плодов в полости матки через 10-11 недель после переноса к числу перенесенных эмбрионов.
В исследовании было показано, что препарат Рековелль не менее эффективен, чем фоллитропин альфа, при оценке по частоте наступления развивающейся беременности и частоте успешной имплантации в цикле переноса «свежих» эмбрионов.
Частота наступления развивающейся беременности и частота имплантации в цикле переноса «свежих» эмбрионов в клиническом исследовании ESTHER-1
|
|
Терапия препаратом Рековелль (N=665) |
Терапия фоллитропином альфа |
Различия |
|
Частота наступления развивающейся беременности |
30,7 % |
31,6 % |
-0,9 % [-5,9 %; 4,1 %] |
|
Частота имплантации в цикле переноса «свежих» эмбрионов |
35,2 % |
35,8 % |
-0,6 % [-6,1 %; 4,8 %] |
Популяция: все рандомизированные и получившие терапию пациентки
Оценка режима дозирования и дозы препарата Рековелль, определенной по концентрации АМГ, дополнительно проводилась по второстепенным показателям, таким, как достижение ответа яичников и риск развития СГЯ.
В итоговой исследуемой популяции среднее количество ооцитов в группе терапии препаратом Рековелль составило 10,0 ± 5,6 (N=636), а в группе терапии фоллитропином альфа с начальной дозой 150 МЕ и последующей коррекцией дозы 10,4 ± 6,5 (N=643).
Среди пациенток с концентрацией АМГ ≥ 15 пмоль/л, выраженность ответа яичников на терапию препаратом Рековелль (N=355) и фоллитропином-альфа (N=353) была следующей: среднее количество ооцитов составляло 11,6 ± 5,9 и 13,3 ± 6,9, а доля пациенток, у которых образовалось ≥ 20 ооцитов - 10,1 % (36 из 355) и 15,6 % (55 из 353), соответственно.
У пациенток с СПКЯ и сохранной овуляцией в циклах с применением антагонистов ГнРГ частота раннего СГЯ умеренной/тяжелой степени тяжести и/или мер по предупреждению раннего СГЯ в группе терапии препаратом Рековелль составила 7,7 %, а в группе терапии фоллитропином альфа 26,7 %.
В контролируемом исследовании, в котором оценивался ответ яичников на индивидуальный режим дозирования препарата Рековелль у пациенток с АМГ ≤ 35 пмоль/л, среднее число ооцитов составило 11,1 ± 5,9 в цикле с агонистом ГнРГ (N = 202) по сравнению с 9,6 ± 5,5 в цикле с применением антагонистов ГнРГ (N=204); средняя продолжительность стимуляции препаратом Рековелль составила 10,4 ± 1,9 дня в цикле с применением агонистов ГнРГ по сравнению с 8,8 ± 1,8 дня в цикле с применением антагонистов ГнРГ.
Безопасность – оценка иммуногенности
Наличие антител к ФСГ оценивалось до и после терапии у пациенток, получавших до трех повторных циклов стимуляции с применением препарата Рековелль (665 пациенток из цикла 1 исследования ESTHER-1, а также 252 пациентки из цикла 2 и 95 пациенток из цикла 3, проведенных в рамках исследования ESTHER-2). Частота обнаружения антител к ФСГ после терапии препаратом Рековелль в цикле 1 составила 1,1 %, в цикле 2-0,8 %, в цикле 3 – 1,1 %. Указанные значения были аналогичны частоте выявления антител к ФСГ, определявшихся до начала введения препарата Рековелль в цикле 1, составившей 1,4 %, и сопоставимы с частотой обнаружения антител к ФСГ после терапии фоллитропином альфа. Титры антител к ФСГ у всех пациенток были крайне низкими или не определялись, кроме того, не обладали нейтрализующими свойствами. Повторные циклы терапии препаратом Рековелль у пациенток с исходно присутствовавшими или появившимися после проведения терапии антителами к ФСГ, не сопровождались увеличением титра антител, не были ассоциированы со снижением ответа яичников и не приводили к развитию НР со стороны иммунной системы.
5.2. Фармакокинетические свойства
Фармакокинетический профиль фоллитропина дельта изучался у здоровых женщин и пациенток, проходящих контролируемую стимуляцию яичников в рамках проведения программ вспомогательных репродуктивных технологий (процедуры ЭКО/ИКСИ). При ежедневном п/к введении равновесная концентрация фоллитропина дельта достигается через 6-7 дней, при этом концентрация препарата в плазме крови в 3 раза превышает концентрацию препарата после первого введения. Концентрация фоллитропина дельта в плазме крови обратно пропорциональна величине массы тела, в связи с чем необходимо подбирать дозировку препарата с учетом массы тела. Системное действие фоллитропина дельта выражено сильнее, чем у фоллитропина альфа.
Абсорбция
При ежедневном п/к введении максимальная концентрация фоллитропина дельта достигается примерно через 10 ч. Абсолютная биодоступность составляет около 64%.
Распределение
После п/к введения кажущийся объем распределения составляет около 25 л, а при внутривенном введении объем распределения 9 л (при достижении равновесной концентрации). В терапевтическом диапазоне выраженность системного действия фоллитропина дельта прямо пропорциональна введенной дозе препарата.
Элиминация
Фоллитропин дельта, предположительно, выводится в основном почками, как и другие фоллитропины. В неизмененном виде почками выводится около 9% действующего вещества. При однократном п/к введении фоллитропина дельта период полувыведения составляет около 40 ч, при последующих п/к введениях – около 28 ч. При п/к введении кажущийся клиренс препарата составляет 0,6 л/ч, а при внутривенном введении – 0,3 л/ч. В связи с выраженным системным действием при последующих введениях препарата наблюдается низкий кажущийся клиренс около 0,6 л/ч, приводящий к высокой эффективности.
5.3. Данные доклинической безопасности
В доклинических данных, полученных по результатам стандартных исследований фармакологической безопасности, токсичности при многократном введении и местной переносимости, особый вред для человека не выявлен. Передозировка фоллитропином дельта приводила к развитию нормальных или чрезмерно выраженных фармакологических эффектов.
Фоллитропин дельта оказывал негативное влияние на фертильность и раннее эмбриональное развитие при введении крысам в дозах ≥ 0,8 мкг/кг/сут, существенно превышающих максимальную рекомендованную дозу для человека. Значение полученных данных для клинического применения препарата Рековелль не изучено в достаточной мере.
6. ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
6.1. Перечень вспомогательных веществ
Фенол
Полисорбат-20
L-метионин
Натрия сульфат декагидрат
Натрия гидрофосфата додекагидрат
Фосфорная кислота концентрированная
Натрия гидроксид
Вода для инъекций
6.2. Несовместимость
Не применимо.
6.3. Срок годности (срок хранения)
3 года.
6.4. Особые меры предосторожности при хранении
При температуре от 2 до 8 °С в оригинальной упаковке (шприц-ручка в пачке картонной).
Не замораживать.
Допускается хранить препарат пациентом при температуре не выше 25 °С не более 3 месяцев, включая период после первого применения.
После первого применения препарат хранить не более 28 дней при температуре не выше 25 °С.
6.5. Характер и содержание первичной упаковки
По 0,36 мл, 1,08 мл или 2,16 мл препарата в картридж из силиконизированного бесцветного стекла типа I объемом 3 мл. Картридж с одной стороны обжат алюминиевым колпачком, лакированным с внутренней стороны в насыщенно золотой цвет с двумя слоями (бромбутил/полиизопрен) резиновой прокладки, с другой стороны укупорен силиконизированным поршнем из резины типа I.
По 1 картриджу с 0,36 мл препарата, встроенному в шприц-ручку, и 3 иглы для инъекций в контурной ячейковой упаковке в пачке картонной с листком-вкладышем.
По 1 картриджу с 1,08 мл препарата, встроенному в шприц-ручку, и 9 игл для инъекций в контурной ячейковой упаковке в пачке картонной с листком-вкладышем.
По 1 картриджу с 2,16 мл препарата, встроенному в шприц-ручку, и 15 игл для инъекций в контурной ячейковой упаковке в пачке картонной с листком-вкладышем.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Нет особых требований к утилизации.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
7. ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
Дания
Ферринг Фармасьютикалс А/С Амагер Страндвей 405, 2770 Каструп.
Тел.: +45 88 33 88 34.
Факс: +45 88 33 88 80.
Электронная почта: production@ferring.com
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
В Российской Федерации:
Российская Федерация
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб., д. 52, стр. 4.
Тел.: +7 (495) 287–0343.
Факс: +7 (495) 287–0342.
Электронная почта: Safety.MailboxRussia@ferring.com
В Республике Казахстан:
Республика Казахстан
Представительство ЧКОО "Ferring Pharmaceuticals B.V." в Республике Казахстан 050000, г. Алматы, ул. Казыбек би, д. 20А.
Тел.: +7 (727) 311–54–47.
Факс: +7 (727) 311–54–47.
Электронная почта: Safety.MailboxKazakhstan@ferring.com
8. НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
ЛП-№(000311)-(РГ-RU)
9. ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
Дата первой регистрации: ЛП-№(000311)-(РГ-RU) – 16.07.2021
10. ДАТА ПЕРЕСМОТРА ТЕКСТА
25 марта 2024г.
Общая характеристика лекарственного препарата Рековелль доступна на информационном портале Евразийского экономического союза в информационно-телекоммуникационной сети
«Интернет» http://www.eec.eaeunion.org/.
ХОРАГОН® (гонадотропин хорионический)
ИНСТРУКЦИЯ
по применению лекарственного препарата для медицинского применения
ХОРАГОН®
Регистрационный номер: П N012469/01
Торговое наименование: Хорагон®
Международное непатентованное наименование: гонадотропин хорионический
Лекарственная форма: лиофилизат для приготовления раствора для внутримышечного введения
Состав
1 флакон с лиофилизатом содержит:
действующее вещество: гонадотропин хорионический высокоочищенный 1500 МЕ или 5000 МЕ,
вспомогательные вещества: лактозы моногидрат 20 мг, натрия гидроксид q.s.
1 ампула с растворителем (натрия хлорида раствор 0,9%) содержит: натрия хлорид 9,0 мг, хлористоводородная кислота разведенная 10% 0,007 – 0,02 мг, вода для инъекций 995,4 мг.
Описание
лиофилизат: лиофилизированная масса от белого до белого с желтоватым оттенком цвета;
растворитель: бесцветный прозрачный раствор.
Фармакотерапевтическая группа: гонадотропины и другие стимуляторы овуляции
Код АТХ: G03GA01
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Хорионический гонадотропин человека (чХГ) представляет собой гликопротеин, состоящий из α-цепи, характерной для лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), и β-цепи, характерной только для чХГ. Выделяется из мочи беременных женщин, неоднороден по составу. Высокоочищенный препарат может содержать несколько фракций сиаловых кислот, различных по активности и содержанию.
Оказывает лютеинизирующее действие, более выраженное по силе по сравнению с ЛГ. Стимулирует синтез половых гормонов в яичниках и яичках.
В яичниках связывается с рецепторами на поверхности тека-клеток и желтого тела, а также с гранулезными клетками фолликулов, стимулируя синтез прогестерона и эстрадиола. В гранулезных клетках небольших фолликулов чХГ в высокой дозе стимулирует синтез эстрадиола, а в гранулезных клетках крупных фолликулов – синтез прогестерона. Также введение чХГ стимулирует выработку биологически активных пептидов, участвующих в регуляции репродуктивной деятельности (например, ингибина, релаксина, проренина, ингибитора активатора плазминогена). Внутримышечное введение чХГ в дозе 5000 – 10000 МЕ женщинам после стимуляции фолликулов (в результате применения гонадотропинов или кломифена) вызывает индукцию овуляции примерно через 36 ч.
В клетках Лейдига чХГ стимулирует синтез тестостерона и других половых гормонов (17-гидроксипрогестерон, эстрадиол). Однократное введение чХГ мужчинам увеличивает концентрацию тестостерона в 2 этапа: первый максимум в плазме крови наблюдается через 2-4 ч, а второй максимум – через 3-4 дня после введения. Максимальная концентрация эстрадиола в плазме крови достигается через 24 ч после введения чХГ. Данные показатели используются при дифференциальной диагностике крипторхизма и анорхизма, а также для оценки функции яичек при гипогонадотропном гипогонадизме.
Фармакокинетика
чХГ вводится внутримышечно. Максимальная концентрация в плазме достигается примерно через 10 ч после инъекции.
чХГ выводится почками. 10 – 20 % введенной дозы обнаруживается в неизменном виде в моче, в то время как основная часть экскретируется в виде фрагментов β-цепи. Период полувыведения составляет около 30 ч, поэтому в случае ежедневных внутримышечных инъекций может наблюдаться кумуляция препарата.
Фармакокинетика в особых клинических случаях
Пациенты с почечной и/или печеночной недостаточностью
Исследования препарата Хорагон® у пациентов с почечной и/или печеночной недостаточностью не проводились.
Показания к применению
Дозировка 1500 МЕ
У мальчиков и мужчин:
- лечение бесплодия у пациентов с гипогонадотропным гипогонадизмом (в комбинации с применением человеческого менопаузального гонадотропина (чМГ) или ФСГ);
- крипторхизм, не обусловленный анатомической обструкцией.
Дозировка 5000 МЕ
У женщин:
- индукция овуляции при бесплодии, обусловленном ановуляцией или нарушением созревания фолликулов;
- подготовка фолликулов к пункции в программах контролируемой гиперстимуляции яичников (для вспомогательных репродуктивных технологий, ВРТ);
У мальчиков и мужчин:
- задержка полового созревания, обусловленная недостаточностью гонадотропной функции гипофиза.
Диагностика:
У мальчиков и мужчин:
- оценка функции яичек при подготовке к проведению стимуляции у пациентов с гипогонадотропным гипогонадизмом;
- дифференциальная диагностика крипторхизма и анорхизма.
Противопоказания
Общие:
- повышенная чувствительность к действующему веществу препарата Хорагон® или к любому из компонентов препарата;
- органические поражения ЦНС, например, опухоли гипофиза, гипоталамуса;
- тромбофлебит глубоких вен.
У женщин:
- беременность и период грудного вскармливания;
- наличие кист или увеличение размера яичников, не связанных с синдромом поликистозных яичников;
- кровотечение или кровянистые выделения из влагалища неясной этиологии;
- гормонозависимые опухоли (рак яичников, матки; молочной железы);
- эктопическая беременность в анамнезе (за 3 месяца до начала лечения);
- синдром гиперстимуляции яичников (СГЯ) в анамнезе;
- первичная недостаточность яичников;
- аномалии развития половых органов (несовместимые с нормальным течением беременности);
- миома матки, несовместимая с беременностью;
- наступление менопаузы.
У мужчин:
- андрогензависимые опухоли (рак предстательной железы, грудной железы, опухоль яичек);
- состояния, связанные с неопущением яичка в мошонку (паховая грыжа, хирургические операции в области паха, эктопия яичка).
С осторожностью:
Препарат Хорагон® применяют у пациентов с ишемической болезнью сердца, хронической сердечной недостаточностью; эпилепсией, мигренью (в том числе в анамнезе); хронической почечной недостаточностью, артериальной гипертензией; у женщин, имеющих факторы риска тромбоза (тромбоз или тромбоэмболия в анамнезе, или у родственников 1-й степени родства; ожирение (индекс массы тела > 30 кг/м2), тромбофилия); у мальчиков в препубертатном периоде.
Применение в период беременности и грудного вскармливания
Применение препарата Хорагон® противопоказано при беременности и в период грудного вскармливания.
Способ применения и дозы
Хорагон® вводится внутримышечно. Лечение препаратом следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия.
Раствор для инъекции должен быть приготовлен непосредственно перед введением с использованием прилагаемого растворителя. Не применять, если в растворе содержатся нерастворенные частицы или он непрозрачен.
Дозировка 1500 МЕ
У мальчиков и мужчин:
При гипогонадотропном гипогонадизме вводят по 1500 МЕ чХГ 2 раза в неделю в комбинации с чМГ или ФСГ (доза чХГ 3000 МЕ в неделю). Лечение должно продолжаться не менее 3 месяцев, в течение лечения должно наблюдаться улучшение сперматогенеза. Перед началом лечения следует прекратить прием препаратов тестостерона, во время лечения необходимо контролировать концентрацию тестостерона в плазме крови. Иногда требуется увеличение дозы чХГ для достижения оптимальной концентрации тестостерона. Если не достигается оптимальный ответ на терапию чХГ, рекомендуется дополнительно вводить чМГ или ФСГ. В случае улучшения состояния при применении комбинированной терапии, для поддержания эффекта рекомендуется продолжать применение чХГ.
Лечение крипторхизма должно быть завершено к концу первого года жизни ребенка. Для лечения крипторхизма у мальчиков в возрасте около одного года рекомендуется следующий режим дозирования: 250 МЕ/доза (0,17 мл из флакона 1500 МЕ) 2 раза в неделю, курс лечения - 5 недель.
Дозировка 5000 МЕ
У женщин:
Индукция овуляции: 5000 МЕ или 10000 МЕ чХГ вводят через 24-48 ч после достижения адекватного ответа яичников. Пациентке рекомендуется иметь половые контакты в день введения чХГ и на следующий день после введения.
Подготовка фолликулов к пункции для проведения ВРТ: вводят 5000 МЕ или 10000 МЕ чХГ через 24-48 ч после последнего введения чМГ или ФСГ, т.е. при достижении оптимальной реакции яичников.
У мальчиков и мужчин:
Для оценки функции яичек при гипогонадотропном гипогонадизме однократно вводят 5000 МЕ чХГ.
Для ускорения полового созревания у мальчиков вводят 5000 МЕ чХГ 1 раз в неделю в течение 3 месяцев.
Диагностика:
Для дифференциальной диагностики крипторхизма и анорхизма у мальчиков однократно вводят 5000 МЕ препарата Хорагон®.
Побочное действие
Наиболее часто наблюдаемые нежелательные реакции связаны с гиперстимуляцией яичников, например, СГЯ. Частота возникновения нежелательных реакций зависит от дозы препарата и от переносимости пациентом проводимого лечения.
Частота побочных эффектов: очень часто (≥ 1/10), часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), редко (≥ 1/10000 до <1/1000), очень редко (<1/10000), частота не установлена (в настоящее время данные о распространенности побочных реакций отсутствуют).
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Частота не установлена |
|
Нарушения со стороны иммунной системы |
|
|
|
Реакции гиперчувствительности (местные и генерализованные реакции), в т.ч. анафилактические реакции и анафилактический шок
|
|
Нарушения со стороны обмена веществ и питания |
|
|
Задержка электролитов и жидкости в организме |
|
|
Нарушения психики |
|
|
Депрессия, раздражительность, повышенная возбудимость |
Эмоциональная лабильность (у мальчиков) |
|
Нарушения со стороны нервной системы |
Головная боль |
|
|
|
|
Нарушения со стороны сосудов |
|
«Приливы» (у мужчин) |
|
Тромбоэмболия |
|
Нарушения со стороны желудочно-кишечного тракта |
|
Тошнота, боль в животе, рвота |
Диарея |
|
|
Нарушение со стороны кожи и подкожных тканей |
|
Экзантема, угревая сыпь |
|
Сыпь, эритема, зуд |
|
Нарушения со стороны половых органов и молочной железы |
Гинекомастия |
СГЯ I или II степени, увеличение молочных желез, боль в яичках |
СГЯ III степени |
Болезненность молочных желез, увеличение полового члена |
|
Общие расстройства и нарушения в месте введения |
Реакции в месте инъекции |
|
|
Повышение температуры тела, слабость, астения |
Передозировка
В связи с применением высоких доз препарата Хорагон® у женщин при индукции овуляции возможно развитие СГЯ IIIстепени.
Симптомы: резкая боль в брюшной полости (особенно в паховой области), тошнота, рвота, диарея, вздутие кишечника, олигурия, тахипноэ, отеки нижних конечностей, в тяжелых случаях – гиповолемия, гемоконцентрация, нарушение водно-электролитного баланса, асцит, перитонит, гидроторакс, острая легочная недостаточность, тромбоэмболические осложнения. Это состояние сопровождается развитием больших кист яичников с опасностью их разрыва и внутрибрюшинного кровотечения, асцитом, гидротораксом и опасностью развития тромбоэмболических осложнений.
Лечение: отмена препарата, при необходимости – госпитализация, назначение симптоматической терапии для коррекции водно-электролитного баланса, нарушений гемостаза и других нарушений.
Случаи передозировки по другим показаниям не наблюдались.
Взаимодействие с другими лекарственными средствами
Препарат Хорагон® не следует смешивать в одном шприце с другими лекарственными средствами!
Следует избегать совместного применения препарата с высокими дозами глюкокортикостероидов.
Хорагон® может усиливать симптомы СГЯ, наступившего в результате применения препаратов чМГ и кломифена.
Особые указания
Общие
Применение чХГ вызывает увеличение секреции андрогенов и задержку жидкости. Препарат Хорагон® следует с осторожностью назначать пациентам с ишемической болезнью сердца, хронической сердечной недостаточностью, артериальной гипертензией; хронической почечной недостаточностью; эпилепсией, мигренью (в том числе в анамнезе).
Тромбоэмболические осложнения
Пациенты с известными факторами риска развития тромбоэмболических осложнений, таких как индивидуальная или семейная предрасположенность, ожирение (ИМТ > 30 кг/м2) или тромбофилия, могут иметь повышенный риск венозных или артериальных тромбоэмболических осложнений во время или после лечения гонадотропинами. В таких случаях необходимо оценить соотношение польза/риск. Следует учитывать, что сама беременность также повышает риск развития тромбоэмболических осложнений.
У женщин
Перед началом применения препарата Хорагон® рекомендуется проведение диагностики бесплодия, а также установление возможных противопоказаний к беременности. Также проводят обследование на наличие гипотиреоза, недостаточности коры надпочечников, гиперпролактинемии, опухолей гипоталамо-гипофизарной области, с последующим назначением соответствующего лечения при необходимости.
Синдром гиперстимуляции яичников:
При контролируемой гиперстимуляции яичников вследствие развития развития множественных фолликулов у пациенток возможно развитие СГЯ.
СГЯ – синдром, отличный от неосложненного увеличения яичников, проявляется более выраженной степенью тяжести. Чрезмерная реакция яичников на введение гонадотропинов редко приводит к развитию СГЯ, если не вводится чХГ с целью стимуляции овуляции. Поэтому в случае гиперстимуляции яичников не следует вводить чХГ, а пациентку следует предупредить о необходимости воздерживаться от половых контактов или использовать барьерные методы контрацепции до начала следующего менструального цикла.
СГЯ может быстро прогрессировать (в течение от 24 ч до нескольких дней), становясь серьезным медицинским осложнением. Чаще всего СГЯ развивается после введения чХГ, признаки раннего начала наблюдаются в течение первых 9 дней после окончания лечения, а признаки позднего начала могут появиться при наступлении беременности. Обычно СГЯ проходит спонтанно после начала менструации. СГЯ может быть более тяжелым и затяжным в случае наступления беременности. В связи с вышеизложенным, пациентки должны наблюдаться, по крайней мере, в течение 2-х недель после введения чХГ.
Клинические проявления СГЯ I и II степени, как правило, проходящие самостоятельно, включают в себя нарушения функции желудочно-кишечного тракта (боль в животе, вздутие живота, тошнота, рвота и/или диарея), увеличение яичников, увеличение массы тела, образование кист яичников. При СГЯ III степени также наблюдаются значительное увеличение яичников, одышка, олигурия. Также выявляются высокая концентрация половых гормонов в крови, гиповолемия, гемоконцентрация, электролитные нарушения, асцит, гемоперитонеум, плевральный выпот, гидроторакс и острый респираторный дистресс синдром. Крайне редко при СГЯ IIIстепени наблюдаются перекрут яичника или тромбоэмболические осложнения.
Для снижения риска развития СГЯ необходимо проводить тщательный контроль реакции яичников на проводимую терапию на основании результатов УЗИ и в сочетании с определением концентрации эстрадиола (до начала терапии и на протяжении применения препарата). Соблюдение рекомендуемой дозы препарата Хорагон, режима введения и тщательный мониторинг проводимого лечения способствуют минимизации частоты развития СГЯ. Путем аспирации содержимого всех фолликулов перед овуляцией при искусственном оплодотворении можно снизить частоту развития СГЯ.
При развитии СГЯ тяжелой степени терапию прекращают, пациентку госпитализируют и начинают специфическую терапию.
Развитие СГЯ более характерно для пациенток с синдромом поликистозных яичников.
Многоплодная беременность:
При многоплодной беременности отмечается повышенный риск неблагоприятных материнских и перинатальных исходов.
При применении чХГ многоплодная беременность развивается чаще, чем при естественном зачатии. Отмечается наиболее высокая частота рождения двойни. Для минимизации риска многоплодной беременности рекомендуется проводить тщательный мониторинг реакции яичников.
В случае проведения ВРТ вероятность возникновения многоплодной беременности зависит от числа введенных эмбрионов, их качества и возраста пациентки.
Пациентка должна быть предупреждена о потенциальном риске многоплодной беременности до начала лечения.
Осложнения беременности:
Частота преждевременных родов и самопроизвольных абортов у пациенток, прошедших ВРТ или стимуляцию роста фолликулов, выше, чем у здоровых женщин.
Эктопическая беременность:
При заболеваниях маточных труб в анамнезе, как при естественном зачатии, так и при лечении бесплодия, у женщин имеется высокий риск возникновения эктопической беременности. Распространенность внематочной беременности после ЭКО составляет от 2 до 5%, по сравнению от 1 до 1,5% в общей популяции.
Новообразования органов репродуктивной системы:
Имеются сообщения о новообразованиях яичников и других органов репродуктивной системы, как доброкачественных, так и злокачественных, у женщин, которые подверглись нескольким схемам введения препаратов для лечения бесплодия. Пока не установлено, увеличивает ли лечение гонадотропинами исходный риск развития этих опухолей у женщин с бесплодием.
Врожденные пороки развития:
Распространенность врожденных пороков развития плода при использовании ВРТ несколько выше, чем при естественном зачатии. Считается, что это может быть связано с индивидуальными особенностями родителей (возрастом матери, характеристиками спермы) и многоплодной беременностью.
Лабораторные показатели
Во время лечения препаратом Хорагон® и в течение 10 дней после прекращения лечения, может отмечаться влияние терапии на показатели иммунологических тестов, на содержание чХГ в плазме крови/моче, что может привести к ложноположительному тесту на беременность.
Препарат Хорагон® содержит натрий, но не более 1 ммоль (23 мг) на 1 мл растворителя.
Применение препарата Хорагон® может привести к положительным результатам допинг-тестов.
Использование препарата Хорагон® в качестве допинга может быть опасно для здоровья.
У мальчиков и мужчин
Препарат Хорагон® следует с осторожностью применять у мальчиков препубертатного периода, чтобы избежать раннего закрытия зоны роста эпифизов костей или преждевременного полового созревания. Необходим регулярный контроль состояния костей и скелета.
При применении чХГ у мальчиков в возрасте около одного года, проходящих лечение крипторхизма, возможно появление признаков воспаления и усиленного апоптоза сперматозоидов.
Влияние на способность управлять транспортными средствами и механизмами
Исследования влияния препарата Хорагон® на способность управлять транспортными средствами и работать с механизмами не проводились. Предполагают, что Хорагон® не оказывает отрицательного воздействия на способность управлять транспортными средствами и другими механизмами.
Форма выпуска
Лиофилизат для приготовления раствора для внутримышечного введения, 1500 МЕ или 5000 МЕ.
По 1500 МЕ или 5000 МЕ лиофилизата во флаконы бесцветного стекла типа I, укупоренные бромбутиловой пробкой с алюминиевой обкаткой и пластиковым колпачком типа «флип-офф».
По 1 мл растворителя в ампулы бесцветного стекла типа I с возможным цветным кодированием в виде цветной точки и/или одного или нескольких колец.
По 3 флакона с лиофилизатом и 3 ампулы с растворителем в контурную ячейковую упаковку. По 1 контурной ячейковой упаковке с инструкцией по применению в картонную пачку.
Срок годности
Лиофилизат: 3 года.
Растворитель: 3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия хранения
При температуре не выше 25 °С. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Условия отпуска
По рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение
Ферринг ГмбХ
Витланд 11, 24109 Киль, Германия.
Производитель
лиофилизат:Ферринг ГмбХ,
Витланд 11, 24109 Киль, Германия.
растворитель: Хаупт Фарма Вюлфинг ГмбХ,
Бетельнер Ландштрассе 18, 31028 Гронау/Лейне, Германия.
С претензиями и за дополнительной информацией обращаться по адресу:
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб., д.52, стр.4.
Тел.: + 7 (495) 287-0342.
Факс: +7 (495) 287-0343.






